|
|
カテゴリーを選択してください
|

FAQs
- 製品に関連する論文や製品データシートで引用している論文のPDFファイルをいただけますか?
-
PDFファイルの提供はいたしかねます。弊社では購読していない雑誌もあることと、さらに著作権の問題も関わりますので、弊社ではご対応いたしかねます。お手数ですがエンドユーザーの皆様がご自身で検索し、論文を入手できるかどうかお調べください。
- 抗体がモノクローナルかポリクローナルかどのようにすれば分かりますか?
-
モノクローナル抗体は1種類のサブタイプの免疫グロブリンであるのに対し、ポリクローナル抗体は複数のサブタイプの免疫グロブリンを含んでいます。したがって、製品のアイソタイプの項目を確認し、IgG1、IgG2a、IgG2b、IgMなどのように表示されている場合、その製品はモノクローナル抗体です。一方、Goat IgG、Rabbit Igなどの場合はポリクローナル抗体です。また、当社のポリクローナル抗体製品の多くは、クローン名にpolyという単語が含まれています。
- 異なる生物種(例えばアカゲザルやカニクイザルなど)と交差反応する抗体を探すにはどうすればよいですか?
-
ウェブページ上部の検索ボックスで、目的の生物種を検索してください。または、Advanced Search (製品案内タブの一番右下)のReactivityで目的の生物種を選択してください。全ての交差反応性抗体の概要に関しては、Antibody Cross‐reactivity Chartをご確認ください。
- 化学物質等安全データシート(MSDS)を入手したいのですが、どうすればよいですか?
-
日本国内のお客様の場合は、BioLegend製品輸入販売元のトミーデジタルバイオロジー株式会社へお問い合わせください。
- 抗体製品を常温で放置した場合、抗体の安定性はどの程度保証されますか?
-
未開封で梱包されている状態の場合、常温で2週間程度置いても問題はありません。しかしながら、極端な温度や光は避けることを推奨します。もしご不安な場合は、事前にテストしてからお使いください。
- BioLegendの品質方針を教えてください。
-
当社では、お客様に100%ご満足いただけることを保証します。もしBioLegend製品が製品データシートに記載されているように機能しない場合は、交換品をご提供します。
- 4°Cでの保存が推奨されている抗体やその他の試薬について、許容される保存温度範囲はどのくらいですか?
-
4°Cでの保存を推奨するすべての製品について、許容範囲は2°Cから8°Cの間です。冷蔵庫の温度がこの範囲外の場合は、設定を調節するか、別の冷蔵庫を使用することを推奨します。
- 抗体の濃度と使用期限を教えてください。また、購入した試薬のCoAを入手するにはどうすればよいですか?
-
購入済み製品の場合、製品のロット番号(Bから始まる番号)をConcentration & Expiration Lookup(濃度および使用期限を調べる場合)やCoA Lookup Tool(CoAを入手したい場合)に入力してください(それぞれのリンク先は下記に記載があります)。まだ製品を購入していない場合、テクニカルサービスにお問い合わせください。
Concentration & Expiration Lookup
Certificate of Analysis - 抗体のエピトープを教えてください。
-
あいにくBioLegendではエピトープマッピングを実施しておりません。もし、文献で報告されているなど情報がある場合は、データシートにエピトープに関する記載があります。しかしながら、通常当社には抗体の正確なエピトープの情報はございませんのでご了承ください。
- BioLegend製品の保存可能期間を教えてください。
-
特に明記されていない限り、当社製品のほとんどは製品データシートに記載の指示に従い適切に保管および取り扱いをした場合、使用期限まで保存可能です。リコンビナントタンパク質の場合、最短保証期間はエンドユーザー様が製品を受け取ってから6ヵ月です。
- 一部の製品が販売中止になったのはなぜですか?
-
通常、お客様からの需要が少ない場合や他に代替品となる製品がある場合に、一部の製品を販売中止することがあります。当社では新しく代替品となる製品と、販売を中止する製品を対照比較し、厳格な品質管理基準を満たしていることを確認しています。なお、販売終了した製品につきましては保証はいたしかねますので、予めご了承ください。
- What is the difference between “Verified” and “Reported” species reactivity noted on antibody product datasheets?
-
Those listed under "verified" reactivity indicate species that have been tested and confirmed to react in-house by BioLegend. Species listed under "Reported" reactivity are those noted by external sources (e.g. literature publications, original antibody developer claims, etc.) but have not been confirmed in-house. Where available, you may be able to find more information by taking a look at the Application Notes and Application References section (under "Product Details") or through literature searches.
FAQs
- When can I expect to receive my order if I order directly from BioLegend?
-
For U.S. orders, if products are in-stock and your order was made before the shipping cutoff time (contact cs@biolegend.com for more info), they are shipped out that day for you to receive the next day. We typically do not ship on Fridays as to avoid packages sitting unattended over the weekend. International direct orders are shipped on Mondays and Fridays, and typically arrive within 2 - 10 days, depending on how long they are in customs.
- Why should I order from a distributor?
-
For direct orders shipped outside the U.S., shipping costs typically start at USD $75 for antibody orders and $175 for dry ice shipment. This could vary country to country. Additionally, prepayment is required for direct international shipments. Also, taxes and duties will be paid by the recipient upon shipment delivery. In some countries, the customer needs to apply for an import permit. When ordering from a distributor, the payment terms are more flexible, the customer and technical support is more immediate, and the customer has greater convenience in not having to deal with customs agencies, duties/taxes, and currency exchange.
- How are BioLegend reagents shipped?
-
Most products are shipped at ambient temperature. Our products are sufficiently stable to maintain optimal performance after overnight shipping.
- Multiple clones are available for a particular specificity, how do I choose the right one?
-
Check the Product Data Sheets on-line to review applications/characteristics for each clone. If you still have questions, please contact BioLegend Technical Services at:
- Toll Free Phone (U.S., Canada): 1‐877‐273‐3103
Phone: 1-858-768-5801
Fax: 858-455-9587 - E-mail: Click Here
- Toll Free Phone (U.S., Canada): 1‐877‐273‐3103
- What is the advantage of ordering per test instead of per μg?
-
Antibodies offered per test have been pre-titrated for optimal performance in flow cytometry assays. Antibodies offered per plate have been pre-titrated in ELISA. Cell Biology antibodies offered per µl have been pre-titrated for Western Blot. The antibody packed in an μg format (untitrated) is not necessarily always from the same batch number as a test format (pre-titrated) though the same procedures are performed in the quality control testing. Please also note that not all test formats of the antibodies have lower concentrations than the μg format. It depends on a particular batch tested. If the optimal concentration were determined at 1 μg/test for a particular batch, then it would be 100 μg in the 100 tests. The advantage to using a pre-titrated format is that it provides more convenience for the optimal performance in areas such as flow cytometry assays, especially for beginners who may save time and reagents on titration of the antibody.
FAQs
- サンプルの一部に異常なシグナルが検出されました。この原因は何でしょうか?
-
フローサイトメトリーや顕微鏡解析でよく使用される蛍光色素の中には、ポリエチレングリコール(PEG)基が組み込まれているものがあります。また、多くの人々の血液中には、検出可能なレベルの抗PEG抗体が含まれています。これらの抗PEG抗体は、特定の濃度で蛍光標識抗体と複合体を形成し、全血を用いて洗浄を行わない方法の解析で異常なシグナルを引き起こす可能性があります。2021年初頭より、全血とPEG化した標識抗体を用いる解析において、異常なシグナルを示すドナーの頻度の増加が観察されるようになりました。予備実験データによると、ドナー集団における抗PEG抗体の頻度および抗PEG抗体レベルが、異常なシグナルと相関関係があることが示唆されています。2021年初頭から広く投与されている新型コロナウイルスワクチンの中には、その成分にPEGが含まれているものがあります。もし、全血を用いる解析を行う場合、そのようなドナー由来のサンプルがあるかもしれません。抗PEG抗体による問題を解決するためには、単純に洗浄ステップを追加するか、ブロッキングバッファーを使用するといったプロトコルの調整を行うことを推奨します。詳細はテクニカルノートをご覧ください。
- 他社のfix/perm バッファー製品は、BioLegendのフローサイトメトリー用抗体と組み合わせて使えますか?
-
当社では、他社のfix/permバッファー製品を用いた検証は実施しておりません。したがって、当社の抗体製品と他社のfix/perm バッファー製品を組み合わせて使えるかどうかは、予備実験などを行ってご確認ください。なお、特定のクローンについて検証されたバッファー系を使用するのが最善である場合があります。
- human Trustain FcX™ (cat# 422302)は、anti‐human CD16 (clone 3GB)、anti‐human CD32 (clone FUN‐2)およびanti‐human CD64 (clone 10.1)と一緒に使用することができますか?
-
はい、お使いいただけます。
- 細胞内染色にFcブロッキングのステップは必要ですか?
-
通常は必要ありませんが、細胞表面染色も行う場合はFcブロッキングのステップを追加してください。
- シアニン色素は単球に非特異的に結合する傾向があるので、単球の表現型解析にはそれらの色素を使用しない方がよいでしょうか?
-
この非特異的な結合に注意してください。サンプルでどの程度の非特異的結合が見られるか、最初に抗体をテストしてみるとよいでしょう。また、フローサイトメトリー用染色を実施する際に、Fcブロッキングや抗体の使用濃度の検討など、バックグラウンドを低減させるための手順に従うことを推奨します。さらに、True‐Stain Monocyte Blocker™ (Cat. No. 426101)を用いて染色結果が改善されるかどうかを確認することもできます。
- PerCP単独の場合と比較して、タンデム色素のPerCP/Cyanine5.5はどの程度安定していますか?
-
PerCP/Cyanine5.5は光安定性が非常に高く、固定に耐えるという点においてもPerCP単独の場合よりも優れています。
- Annexin V(アネキシンV)とPhosphatidylserine(ホスファチジルセリン)の結合に、pHと染色温度はどのように影響しますか?
-
pH5.2未満の場合や、42°Cを超える温度で長時間インキュベーションした場合、Annexin Vとホスファチジルセリンの結合は失われます。
- 抗体1分子にどのくらいの数のビオチン分子が結合していますか?
-
当社では、抗体製品に標識しているビオチン分子の数について定期的な測定は行っておりませんが、通常、抗体1分子あたり3から6分子のビオチンが結合しています。
- 血液やPBMCサンプルをanti‐human CD357 (GITR) クローン621で染色すると、染色が弱いのですが。
-
当社の試験では、血液やPBMCをサンプルとした場合、anti‐human CD357 (GITR)クローン621による染色が弱くなることが示されています。したがって、この抗体製品はGITRの発現レベルが高い状況、例えば刺激した細胞や、GITRの発現が高い特定の細胞株にのみ適している可能性があります。
- 必要な抗体製品について複数のクローンがあるのですが、どれを選択したらよいですか?
-
特定のクローンを探しているのでなければ、PubmedやGoogle Scholarでどのクローンが最もよく使用されているか確認することを推奨します。これにより、あるクローンが別のクローンと比較してどのくらい頻繁に使われているのかが分かります。
- T細胞活性化後にCD3やCD4などのT細胞マーカーの発現を検出することができません。
-
T細胞表面のTCR‐CD3複合体は、ペプチド‐MHC複合体やスーパー抗原、抗TCR抗体または抗CD3抗体によるクロスリンクによって活性化されると急速に発現が減少します。また、PMA/イオノマイシン処理は細胞表面のCD4発現を減少させることが示されています。受容体の発現減少は一般的な生物学的現象ですので、刺激処理したサンプルでそのような現象が引き起こされている可能性がないかご確認ください。
- 同じターゲットに対して、異なる供給元からの異なる2種類のクローン由来の抗体で染色したところ、これらの抗体間で一貫した染色結果を得ることができません。何が問題なのでしょうか?
-
ポリクローナル抗体かモノクローナル抗体かなどの特性の違いや供給元が異なるといった点は、一貫性の無い染色結果をもたらす要因です。同じターゲットに対するモノクローナル抗体とポリクローナル抗体を比較した場合、特に違いが顕著になる可能性があります。また、2種類の抗体がモノクローナル抗体であっても、染色パターンが異なる可能性があります。関連する文献を調べてみるのがよいでしょう。
- コンペンセーション用ビーズと蛍光標識抗体を用いて、シグナルを検出できなかったのですが。
-
コンペンセーション用ビーズを用いる場合は、ビーズの詳細、例えば抗体の特定の軽鎖や、特定の宿主由来抗体には使用不可である、といった点をよく確認してからお使いください。
- FOXP3抗体について、どのクローンを使えばよいですか?
-
ヒトFOXP3を検出する抗体に関する当社の検討では、クローン259Dとクローン206Dのどちらも同等の染色結果を示しています。クローン206Dとクローン259Dの違いについては、Tregのページをご覧ください。クローン206Dは、ヒトFOXP3の105から235番目までのアミノ酸配列領域に位置するエピトープを認識します。クローン259も、ヒトFOXP3の105から235番目までのアミノ酸配列領域に位置するエピトープを認識します。他の哺乳類の場合、クローン150Dを推奨します。詳細はTregのウェブページをご覧ください。
- ある細胞集団を調べたいのですが、おすすめのマーカーはありますか?
-
細胞のマーカーについては、Cell Markerウェブページを参照してください。より効率的に調べたい場合はEssential Markersウェブページをご覧ください。また、特定の細胞種の詳細については、文献を参照することも推奨します。
- PE標識にはどのタイプのPEを使用していますか?
-
標識にはR‐PEを使用しています。
- 蛍光標識抗体に含まれている0.09%アジ化ナトリウムは、ソーティングした細胞の生存率に影響しますか?
-
染色のために抗体を希釈することで、アジ化ナトリウムも細胞には毒性が無い程度の濃度に希釈されると考えられます。また、細胞とアジ化ナトリウムを含む抗体を反応させる時間は30分間程度と短時間で、さらに細胞を洗浄する過程があるため、ソーティングの際のバッファー中にはアジ化ナトリウムがほとんど残っていません。したがって、残存するアジ化ナトリウムによる毒性が影響する可能性は非常に低いと考えられます。
- なぜAnti‐Neu5Gc kit (cat# 146901)には専用のブロッキング溶液が含まれているのですか?自分で用意したブロッキング溶液を使うことはできますか?
-
一般的によく使用されるブロッキング溶液にはFBSが含まれており、これによりサンプル中にNeu5Gcが混入することで、バックグラウンドが生じる可能性があります。キットに含まれているブロッキング溶液は、このようなNeu5Gcの混入が無いことを保証しています。
- 細胞内染色によるサイトカインの染色結果とELISAの結果に良好な相関関係が見られないのはなぜですか?
-
フローサイトメトリーを用いた細胞内染色によるサイトカインの検出は、ある時点でのサイトカイン分泌を示しており、一方、ELISAは時間の経過に伴って蓄積したサイトカインを検出しているからです。
- フローサイトメトリーやELISAで使用可能な抗体が、ウェスタンブロットでは機能しないことがあるのはなぜですか?
-
フローサイトメトリーやELISAで使用可能な抗体は、三次元構造のエピトープを認識することによって機能していることがあります。ウェスタンブロットで行われるサンプルを加熱させるような激しい処理により、ターゲットのエピトープが直線化し、抗体によって認識されなくなる可能性があります。
- マウスCD206を細胞表面染色ではなく細胞内染色によって染色するのはなぜですか?
-
通常の条件下ではマウスCD206の細胞表面における発現レベルは比較的低いので、より良いシグナルを得るためには細胞内染色が必要なためです。
- Human TruStain FcX™ (Fcレセプターのブロッキング溶液、cat# 422301)の濃度を教えてください。
-
あいにく、本製品の濃度は開示いたしかねます。
- 抗体の分子量を教えてください。
-
抗体製品の分子量につきましては、社内ではテストしておりません。通常、IgGの分子量はおよそ150 kDです。
- IL‐17が染まらない一般的な原因は何ですか?
-
IL‐17の細胞内染色で失敗する場合は、刺激に問題があることが多いです。PMAやイオノマイシンは液体の場合、非常に不安定です。したがって、1回分ずつ分注して‐20°Cで保管することを推奨します。分注した溶液は常温で融解し、刺激する直前にPBSで使用する濃度に希釈してください。
- 抗ヒトCD20抗体のクローン2H7とクローン1412の違いは何ですか?
-
クローン1412:このクローンはCD20の細胞質内ドメインを特異的に認識するので、細胞内染色を用いたフローサイトメトリー解析にのみお使いいただけます。この場合、固定と透過処理のステップを実施する必要があります。細胞内染色のプロトコルに従い実験を行ってください。
クローン2H7:このクローンは一般的な細胞表面染色用の抗CD20抗体としてお使いいただけます。固定や透過処理のステップは必要ありません。
プロトコルはこちらでご覧ください。 - テストサイズ製品とµg サイズ製品の違いは何ですか?
-
テストサイズ製品は、100万個の細胞を100 µLの容量で染色する場合に最適な結果が得られるよう事前に調製しています。一方、µgサイズ製品は最適な使用濃度に関わらず、定められた濃度となっています。なお、テストサイズかµgサイズかといった違いに関わらず、目的の抗体と同じ重量(µg)で正しいアイソタイプコントロールを使用することが非常に重要です。抗体の濃度がバイアルに記載されていない場合、テクニカルサポートまでお問い合わせください。
- 蛍光標識抗体のF/P比はどのくらいですか?
-
PEやAPCおよびこれらのタンデム色素で標識された抗体のF/Pは1:1です。FITCやAlexaシリーズの色素など他の蛍光色素の場合、様々なF/P比ですが、通常は3~7の範囲内です。
- BV421™標識抗体のF/P比の範囲はどのくらいですか?
-
ロット毎に異なりますが、平均すると2~4の範囲内です。
- Annexin Vの染色にRPMI培地を使用できますか?
-
製品データシートに記載されているプロトコルに従うことを推奨します。また、RPMI 1640培地には比較的高濃度のリン酸塩が含まれていることと、カルシウムイオン濃度が低いことから、Annexin Vのホスファチジルセリンへの結合に悪影響を及ぼします。なお、Annexin Vを用いるアポトーシスの測定は、氷上での反応時間、カルシウム濃度、および培地の種類によっても大きく影響を受ける可能性があります。
- 推奨使用量よりも低い濃度や少ない量の抗体を使用できますか?
-
抗体の使用濃度の検討を行うことを推奨します。これにより、お客様の実験において使用する抗体が少なくても問題ないかどうかを判断することができますし、特定の実験においてお客様ご自身で使用した場合に、抗体がどのように機能するかを確認することが可能です。
- ソーティングにBioLegendの抗体を使用できますか?
-
一般的に当社の抗体は細胞のソーティングに使用できますが、社内で定期的な試験は実施していません。蛍光標識抗体はエンドトキシン試験を行っておらず、また0.09%アジ化ナトリウムが含まれていることにご注意ください。アジ化ナトリウム濃度は低いため、通常、この程度の量であれば細胞の生存率に影響しないと考えられます。抗体により細胞が活性化される可能性については、通常、染色用抗体とのインキュベーション時間は約20分程度と短いため、活性化を引き起こすことはないはずです。 細胞と抗体のインキュベーションを4°Cまたは氷上で行うことで、活性化を防ぐことができます。
- GFP、CFSE、FITCは同じチャンネルで検出できるので、これらの蛍光補正のために同一のコンペンセーション用コントロールを使用することは可能ですか?
-
同じチャンネルで検出される蛍光色素であっても、これらは蛍光強度が異なるため、おすすめはしません。それぞれ個別のコンペンセーション用コントロールを準備する方がよいです。
- 1テストごとの推奨量よりも少ない反応液量、あるいは少ない細胞数で使うことはできますか?
-
はい、抗体濃度が変化しない限り、1テスト当たりの細胞数または反応液量を減らすことができます。例えば、染色の際の反応液量を100 uLから50 uLに減らす場合、使用する抗体も半分に減らすことができます。ただし、細胞数を100万から100,000個に減らしたが、反応液量は100 uLのままであるような場合には、データシートで推奨している量の抗体を使う方がよいでしょう。
- タンデム色素は、ロットや供給元によって異なりますか?
-
完全に等しく作製されるタンデム色素は二つとありません。同じ種類のタンデム色素の場合、メーカー間、あるいはロット間でも違いが生じる可能性があります。一貫性を保つために、同一の研究課題においては同じ供給元、さらに可能であれば同一ロットのタンデム色素を使用するのが良いかもしれません。
- コンペンセーション用コントロールとして、同じタンデム色素が標識されているが特異性が異なる抗体を使用できますか?
-
タンデム色素は供給元やロットが異なると違いが生じる可能性があるため、サンプルに使用する抗体と同一の抗体をコンペンセーション用コントロールに使う方がよいです。蛍光補正のために、コンペンセーション用ビーズを使用するのが適している場合もあります。
- ある特定クローンの抗体について、固定した細胞でも使用できますか?
-
そのクローンの製品ウェブページに情報が無い場合、そのクローンが固定したサンプルで使用できるかどうかを検討していない可能性があります。そのような場合、そのクローンに関する文献を調べてみることが望ましいです。詳細についてはこちらをご覧ください。
- 一次抗体と二次抗体を事前にインキュベートすることは可能ですか?
-
二次抗体が一次抗体のFc領域に結合する場合、理論的には可能です。しかしながら、もし二次抗体が軽鎖にも結合する場合、その結合が一次抗体の標的への結合能を妨げる可能性があります。したがって、そのような使い方をする場合には事前にテストする必要があります。
- 後でフローサイトメトリー解析するために、血液サンプル(EDTAを抗凝固剤として使用)を保管しても大丈夫ですか?
-
EDTAを加えた血液は、24時間以内に使用することが望ましいです。
- FOXP3染色用のキット製品を使用して、全血を染色できますか?
-
そのような使い方は推奨しません。この染色にはPBMCを使用することが望ましいです。
- FOXP3とサイトカインを共染色できますか?
-
FOXP3染色のために核膜透過処理をしますが、その処理によりかなり大きな穴が開きます。そこからサイトカインが細胞外へ漏れ出すことで、低発現のサイトカインの検出が難しくなる可能性があります。細胞膜のみ透過処理をした細胞をコントロールとして使用する必要があるかもしれません。
- Annexin Vおよびその標識製品を凍結してもよいですか?
-
二量体化により生物学的活性が消失するので、凍結は避けてください。
- フローサイトメトリー用抗体を凍結してもよいですか?
-
凍結すると抗体が変性したり、凍結融解により蛍光色素が抗体から分離する可能性があるため、抗体を凍結することは推奨しません。さらに、抗体が凝集し、その凝集体が細胞に非特異的に結合する可能性があります。したがって、フローサイトメトリー用抗体は遮光して4°Cで保管することを推奨します。
- 蛍光色素だけを別売りしていますか?
-
蛍光色素単体の販売はしておりませんが、カスタム標識サービスはご提供しています。詳細はこちらへ問い合わせください。
- anti‐mouse IL‐17 antibody(クローン TC11‐18H10.1)はIL‐17Aアイソフォームを認識しますか、それともIL‐17Fアイソフォームを認識しますか?
-
クローンTC11‐18H10.1はIL‐17Aアイソフォームを認識します。しかしながら、IL‐17Aへの結合を介してIL‐17A/Fヘテロダイマーも検出します。
- アジ化ナトリウムや血清およびBSAなどのキャリアタンパク質は標識を阻害しますか?
-
0.09% (w/v)までのアジ化ナトリウムであれば、アミン反応性またはスルフヒドリル反応性の標識を妨げません。一方、血清やBSAなどのキャリアタンパク質はこのような標識反応を阻害します。
- 室温や37°Cでの染色は、ケモカイン受容体の発現を確認するのに役立ちますか?
-
多くのケモカイン受容体は継続的にリサイクルされます。したがって、低温での染色(受容体の代謝回転が低下する可能性がある)では最適でない場合に、室温や37°C で染色することを検討する価値があるかもしれません。
- anti‐CD61抗体によって検出されるシグナルは、動物の加齢に伴い低下しますか?
-
ある研究(Asselin‐Labat, ML et al. 2007. Nat. Cell Biol. :201)によると、CD61の発現レベルは年齢や妊娠段階によって異なる可能性があります。4‐8週齢のマウスでCD61をテストするのがよいかもしれません。
- 標識用キット製品はありますか?
-
あいにく、標識用キット製品はございません。
- フローサイトメトリー用製品の品質管理試験に使用している細胞株を販売していますか?
-
当社では細胞株のご提供はしておりません。American Type Culture Collection http://www.atcc.org/ で入手できるかもしれませんのでご確認ください。
- BioLegendでは、フローサイトメトリー染色用の至適抗体濃度をどのように選択しているのですか?
-
通常、ターゲットタンパク質を発現しており一般的によく使用される細胞(利用可能な場合)を用いて、4から6通りの希釈で試験します。その後、S/N比 (Signal/Noise ratio)に基づき至適濃度を決定します。
- FC用とICFC用の抗体製品では組成に違いがありますか?それぞれ異なる至適濃度ですか?
-
FCは細胞表面染色用で、ICFCは細胞内染色用です。これらの濃度は異なる場合があります。細胞内染色用の抗体およびアイソタイプコントロール製品は、細胞内染色において最適な性能を発揮できるように最適化した蛍光色素標識特性を有しています。
- PerCP単独の場合と比較して、タンデム色素のPerCP/Cy5.5はどの程度安定していますか?
-
PerCP/Cy5.5は光安定性が非常に高く、固定に耐えるという点においてもPerCP単独の場合よりも優れています。
- アイソタイプコントロールは、どの濃度あるいは重量で使う必要がありますか?
-
アイソタイプコントロールの使用濃度や重量が、一次抗体の使用濃度や重量と一致していることを確認してください。なお、アイソタイプコントロールと一次抗体の元の濃度は必ずしも同じではありません。したがって、同じ容量を用いても、同一の重量にはならないことがあります。
- 細胞内サイトカイン染色のために細胞を刺激したいです。おすすめの方法を教えてください。
-
stimulation guideをご覧ください。
- バルクオーダーやカスタム標識、カスタム抗体作製、Ultra-LEAF™フォーマットに関してリクエストがあるのですがどうすればよいですか。
-
営業担当までご連絡ください。
- Ultra-LEAF™ フォーマットの抗体製品はin vivoまたはin vitroのアプリケーションで検証済みですか?
-
特に記載がない限り、当社の抗体製品はin vivoあるいはin vitroのアプリケーションによる試験は実施しておりません。製品によっては、データシートにその製品を用いたバイオアッセイに関する文献が記載されていることがあります。その抗体クローンに関する情報を見つけるために、さらに文献を調べてみることをおすすめします。
- 抗体濃度はどのように決定していますか?
-
分光光度計で280 nmにおける吸光度を測定することで濃度を計算しています。濃度はOD280 x 希釈係数/吸光係数で算出されます。アイソタイプがIgGである抗体の吸光係数は1.4です。
- I observed multiple positive peaks when running Compensation Beads. What could be causing this?
-
Multiple positive peaks can occur from insufficient vortexing or mixing of compensation beads. Be sure to vigorously vortex beads for at least one minute before dispensing drops. Longer vortexing helps to disrupt aggregates that can form during storage. Also, ensure that any stray droplets sticking to the side of the tube are thoroughly mixed in with your sample before incubation. If you have already prepared your single-color controls and do not wish to remake them, try setting your positive gate on the major peak, excluding minor stained populations.
FAQs
- サンプルの一部に異常なシグナルが検出されました。この原因は何でしょうか?
-
フローサイトメトリーや顕微鏡解析でよく使用される蛍光色素の中には、ポリエチレングリコール(PEG)基が組み込まれているものがあります。また、多くの人々の血液中には、検出可能なレベルの抗PEG抗体が含まれています。これらの抗PEG抗体は、特定の濃度で蛍光標識抗体と複合体を形成し、全血を用いて洗浄を行わない方法の解析で異常なシグナルを引き起こす可能性があります。2021年初頭より、全血とPEG化した標識抗体を用いる解析において、異常なシグナルを示すドナーの頻度の増加が観察されるようになりました。予備実験データによると、ドナー集団における抗PEG抗体の頻度および抗PEG抗体レベルが、異常なシグナルと相関関係があることが示唆されています。2021年初頭から広く投与されている新型コロナウイルスワクチンの中には、その成分にPEGが含まれているものがあります。もし、全血を用いる解析を行う場合、そのようなドナー由来のサンプルがあるかもしれません。抗PEG抗体による問題を解決するためには、単純に洗浄ステップを追加するか、ブロッキングバッファーを使用するといったプロトコルの調整を行うことを推奨します。詳細はテクニカルノートをご覧ください。
- Brilliant Violet™とは何ですか?
-
Brilliant Violet™(BV)は405 nmのバイオレットレーザーで励起される、高輝度のポリマー蛍光色素ファミリーです。ノーベル化学賞を受賞した技術を基に、Sirigen社によって開発されました。この蛍光色素ファミリーには、BV421™、BV510™、BV570™、BV605™、BV650™、BV711™およびBV785™の7種類の蛍光色素があります。現在市販されている405 nmで励起される他の蛍光色素と比べて、これらの蛍光色素はそれぞれ独自の蛍光スペクトルと利点を有しています。Brilliant Violet™蛍光色素は細胞表面または細胞内染色のフローサイトメトリーに適しており、バックグラウンドが低く良好なシグナルを検出できます。励起および蛍光スペクトル、試験データ、推奨のフィルターや類似する蛍光色素、各蛍光色素の利点やマルチカラーパネルに組み込むためのアドバイスについては、Brilliant Violet™ページをご覧ください。
- これら複数のBrilliant Violet™を一緒に使用することは可能ですか?
-
はい、お使いいただけます。なお、良い結果が得られている他のマルチカラーパネルと同様に、あるPMTが他のPMTと著しく異なることがなく、PMT電圧のバランスが保たれていることは有益です。PMT電圧が不均衡な状況では、ある蛍光色素から他の蛍光色素への漏れ込みが増幅される可能性があります。また、染色前に複数のBrilliant Violet™蛍光色素を混合しておき、混合溶液の状態で長時間経過すると、蛍光色素間の相互作用が起こる可能性があります。
- それぞれのBrilliant Violet™蛍光色素を検出するために、どのバンドパスフィルターを使用すればよいですか?
-
各Brilliant Violet™蛍光色素に推奨するフィルターは次の通りです。
・BV421™ : 450/50(Pacific Blue™用フィルター)
・BV510™ : 510/50
・BV570™ : 585/42(Pacific Orange™用フィルター)
・BV605™ : 610/20と595LP(Qdot® 605用フィルター)
・BV650™ : 660/20と630LP(Qdot® 650用フィルター)
・BV711™ : 710/50と685LP(Qdot® 700用フィルター)
・BV785™ : 780/60と750LP(Qdot® 800用フィルター)
励起スペクトルおよび蛍光スペクトルの詳細なデータについては、Fluorescence Spectra Viewerをご覧ください。 - 他の蛍光色素と比較して、Brilliant Violet™の性能はどの程度ですか?
-
Brilliant Violet 421™は優れたS/N比を示します。Pacific Blue™の場合よりも10倍以上優れていることもあります。バイオレットレーザーで励起した場合、PEと同等以上の明るさです。
Brilliant Violet 510™は非タンデムポリマー蛍光色素で、Pacific Orange™やAmCyan、Horizon™ V500よりも優れています。
Brilliant Violet 570™もPacific Orange™より6倍ほど優れています。
Brilliant Violet 605™とBrilliant Violet 650™はそれぞれeFluor® 605やeFluor® 650よりも10倍程度明るいですが、Qdot® 605ほどは明るくありません。
Brilliant Violet 711™はeFluor® 700やeFluor® 650よりも10倍程度明るいですが、Qdot® 705ほどは明るくありません。
Brilliant Violet 785™はQdot® 800と同程度の明るさです。
BV605™, BV650™, BV711™およびBV785™はナノクリスタルではないため、細胞内染色においてより良い染色性を示す可能性があり、固定による影響を受けません。詳細はこちら - Brilliant Violet™を顕微鏡を用いた解析に使用できますか?
-
はい。Brilliant Violet 421™は非常に明るく、光安定性も高いので、顕微鏡を用いる解析にも適しています。データを見る
FAQs
- BioLegendがCovanceとこの契約を締結することにしたのはなぜですか?
-
BioLegendは製品ポートフォリオを神経科学、免疫病理学およびIHC用試薬などの新しい分野へ拡大しようとしています。Covanceの抗体製品グループが加わることにより、BioLegendのカタログ製品が増加するだけでなく、これまで手薄だった分野を補完することになります。
- なぜCovance社は抗体事業部門をBioLegendへ売却したのですか?
-
売却の目的は、抗体事業部門をより成長させ、ビジネスを拡大できるような組織に所属させるためでした。BioLegendはライフサイエンス研究用に包括的で最先端の高品質な試薬を提供しており、研究用ツールにおける強力なバックグラウンドを有し、積極的に製品開発をしています。BioLegendのこのような取り組みは、抗体製品グループの商業的な成長を促進し、さらに従業員にとって大きなキャリアチャンスにもなると確信しています。
- この統合は、製品のディスカウントにどのように影響しますか?
-
お客様の研究室におけるディスカウントの詳細については、営業チームにお問い合わせください。
- 旧Covance社の製品名と製品番号で注文した場合、カスタマーサービスで注文を処理することは可能ですか?
-
はい。当社の受注システムでは以前の製品番号でも新しい製品番号でも注文を処理できます。しかしながら、以前の製品番号は段階的に使用を中止するため、特にご注文がシステム上で自動的に生成される場合は、新しい製品番号の使用に移行することを推奨します。
FAQs
- BioLegendでは各種Ultra-LEAF™ antibody製品を機能的アッセイで試験していますか?
-
いいえ。特に記載がない限り、当社では機能的アッセイによるUltra-LEAF™ antibodyシリーズ製品の試験はしていません。機能的アッセイには様々な種類があるため、機能性抗体を使用した場合の結果の複雑さと変動が起こる可能性があるという理由、および製品数も多いという理由から、現在、ルーチンの品質管理試験では機能的アッセイを実施していません。しかしながら、抗体が機能的アッセイで用いられている参考資料がある場合にはその情報をご提供します。また、当社の厳格な仕様基準に基づいて、抗体の特異性と品質を検証するために品質管理試験を実施しています。
- BioLegendではUltra-LEAF™ antibody製品の潜在的病原菌について検査していますか?
-
いいえ。特に記載がない限り、社内で病原体の試験は行っていません。しかしながら、必要に応じて外部機関でそのような試験を実施することを推奨します。
- 機能的アッセイを行う予定です。どのグレードの精製抗体を選べばよいですか?
-
BioLegendのUltra-LEAF™ (Ultra-Low Endotoxin, Azide-Free) purified antibodyは機能的アッセイ用に特別に作られた製品で、悪影響を抑え、正確な結果が得られます。Ultra-LEAF™抗体のエンドトキシンレベルは< 10 EU/mgです。また、GoInVivo™抗体は病原体検査済みでエンドトキシンレベルが< 1 EU/mgの抗体製品です。
- BioLegendではGMPグレードの抗体を製造していますか?
-
IVDまたはASR製品は登録済みのGMP専用施設で製造しています。その他の製品はISO 13485認証に基づいて製造しています。どちらの場合も高品質な製品を提供します。当社の品質基準の詳細については、Quality Controlページhttps://www.biolegend.com/QCをご覧ください。
FAQs
- IgG2a遺伝子を持たないマウスの系統があるようですが、どのマウスですか?
-
C57Bl/6、C57Bl/10、SJLやNODなどのマウスにはIgG2a遺伝子がありません。代わりに、IgG2c遺伝子を有しています。
- 細胞内染色のフローサイトメトリー(ICFC)用として推奨されているアイソタイプコントロールを、細胞表面染色用のアイソタイプコントロールとして使用することは可能ですか?
-
ICFC用にはICFCで検証したアイソタイプコントロールを使用し、細胞表面染色用には細胞表面染色で検証したアイソタイプコントロールを使用するのが最善です。
- テストサイズ製品に使用するアイソタイプコントロールの量を調べるにはどうすればよいですか?
-
抗体バイアルのラベルに抗体濃度が記載されている場合がありますので、ラベルをご確認ください。記載が無い場合、濃度についてテクニカルサポートへお問い合わせいただくか、lookup toolでロット番号から濃度を検索してください。使用する一次抗体の濃度とアイソタイプコントロールの濃度が同じになるようにお使いください。
- 使用する一次抗体に適切なアイソタイプコントロールをどのように選択すればよいですか?
-
それぞれの一次抗体のアイソタイプとフォーマットを確認し、アイソタイプコントロールがそれらと適切に一致するようにします。例えば、アイソタイプがRat IgG1, kであるPE標識一次抗体である場合、Catalog# 400407または400408のPE Rat IgG1, k isotype controlを使用します。ご参考までに、多くの製品で"related products"の欄にアイソタイプコントロールが記載されています。
- フローサイトメトリーにおけるアイソタイプコントロールに関して、rat IgG1, lambdaアイソタイプをrat IgG1, kappaに置き換えることは可能ですか?
-
はい、可能です。Kappa鎖とlambda鎖は軽鎖であり、バックグラウンド染色に寄与しないため、置き換えることができます。
FAQs
- LEGEND MAX™ ELISA Kitではサンプルを加える前にプレートを洗浄するステップがあります。このステップの目的は何ですか?
-
通常、固相化済みプレートには安定剤が使用されています。サンプルを加える前の洗浄ステップは、アッセイを開始する前に安定剤を除去するために行います。もし洗浄を行わなかった場合でも、アッセイの性能への影響はごくわずかです。
- ELISAキットで使われている抗体クローンは何ですか?
-
当社のキット製品で使用している抗体クローンに関する情報は、あいにく開示いたしかねます。しかしながら、抗体のクローン性(ポリクローナルかモノクローナルか)および抗体の宿主動物種に関する情報は、ご要望に応じてお答えできる場合もございます。
- ELISA実験では、血清と血漿のどちらを使う方がよいですか?
-
これは、お客様の研究の詳細とどのようなターゲットを解析するかにより異なります。理想的には、目的のターゲットについて血清と血漿での違いを判断し、定量に用いるサンプルの種類を決めることを推奨します。ターゲットによっては、血清と血漿でターゲットの濃度が異なる場合があります。血漿や血清サンプルを準備する際に最も重要な点は、正確な測定ができるよう、サンプル調製の一貫性を保つことです。一般的に血漿および血清サンプルは、粒子状物質や過剰な脂質が含まれておらず、溶血していない状態であることが望ましいです。このような混入物が存在しているとバックグラウンドが高くなり、アッセイの精度に悪影響を及ぼします。重要な点は、毎回同じ方法でサンプルを準備することです。すなわち、サンプルの遠心分離は常に同じ速度と同じ時間で行い、遠心後は速やかに血清または血漿を分けて、さらにサンプルを分注し凍結保存します。また、凍結融解の繰り返しは避けてください。
- サンプル中の測定対象物の含有量が非常に低レベルである可能性があります。検出を改善するために、どのような方法がありますか?
-
LEGEND MAX™ および ELISA MAX™ Deluxe製品をお使いの場合、製品に付属のプロトコルに従うことを推奨します。プロトコルに従わずに実験を行った場合、キット製品の性能を保証することができません。ELISA MAX™ Standard製品をお使いの場合、以下の項目をご検討ください。
• 洗浄の回数と洗浄間の浸漬時間を増やすことで、バックグラウンドノイズをコントロールします。
• アッセイの精度をコントロールします。例えば、ピペッティングをより注意深く、一貫性が保たれているように操作します。また、avidin-HRPの汚染を防ぐために、プレートの水気を除去する際に新しいペーパータオルを使用します。さらに、洗浄液の容量を増やします。
• インキュベーション時間を長くします。通常、これによりバックグラウンドも増加するため、アッセイの感度が必ずしも増加しない場合があることにご注意ください。
• 可能であればサンプルを濃縮します。
• 5パラメータロジスティックカーブフィッティング法を用いて、標準曲線の下端でより正確にサンプル濃度を計算できるようにします。多くの場合、サンプルに含まれている分析対象物が非常に低いレベルか検出限界以下である可能性もあります。そのような場合には、アッセイの条件を変化させても検出可能な濃度が得られないこともあります。
- ELISAキットの捕捉抗体や検出抗体を使い切ってしまいました。キットの構成品ではない、単品の抗体製品を代わりに使うことはできますか?
-
いいえ。キットの構成品の代わりに単品の試薬を使うことは推奨しません。また、異なるキット製品や異なるメーカーの試薬と交換したり組み合わせて使用した場合、キット製品の性能を保証することはできませんので予めご了承ください。
- キット製品で測定できるサンプル数はいくつですか?
-
これは、サンプルを二重測定するか三重測定するかによって異なります。例えば、スタンダードを加えた後、レプリケート無しであれば80サンプルを測定できることになりますし、二重測定にすると40サンプルを測定できることになります。
- 固相化後のプレートはどのように保管するのがよいですか?
-
固相化したプレートをすぐに使用できない場合は、密封して 4°Cで一晩保存してください。
- 複数のLEGEND MAX™ ELISA kitを同時に使用したいのですが、すべてのキットに同じwash bufferを使うことはできますか?
-
各種LEGEND MAX™ ELISA kitに含まれているwash bufferは、すべて同一のwash bufferです。Wash bufferのボトルに記載されているPart No.が同一であることをご確認の上、お使いください。
ELISA MAX™ Deluxe kitおよびELISA MAX™ Standard setの場合、各キット製品のデータシートにwash bufferの組成が記載されています。この組成は、すべてのELISA MAX™製品で共通です。 - ELISA MAX™ Deluxe setのassay diluentを使い切ってしまったのですが、assay diluentだけ購入できますか。
-
Cat. No. 421203のassay diluentをご注文ください。
- 同一クローンのビオチン標識抗体と未標識精製抗体を用いて独自のELISA測定系を立ち上げようとしているのですが、期待通りの結果が得られません。
-
検出抗体と捕捉抗体の両方に同一クローンを使用している場合、どちらかの抗体が既にエピトープに結合しており、もう一方の抗体との結合が阻害されている可能性があります。捕捉抗体と検出抗体にはそれぞれ異なるクローンを選択することを推奨します。
- ELISAに関するトラブルシューティング情報はどこで見ることができますか?
-
こちらのELISA troubleshooting guideをご覧ください。
- LEGEND MAX™ ELISA kitはどのような場合に選択するとよいのでしょうか?
-
ELISAを実施するのが初めての方には、LEGEND MAX™ Kitを推奨しています。LEGEND MAX™ Kitには固相化済みのプレートが含まれていますので、プレートの準備や試薬の調製などに必要な時間を最小限に抑え、すぐにお使いいただけます。
- ELISAの固相化バッファーには何を使えばよいですか?
-
一般的には、PBS (pH 7.4)またはcarbonate buffer (pH 9.5)を推奨します。最適な固相化バッファーは、検出したいサイトカインによって異なります。
- ELISAで用いるバッファーにアジ化ナトリウムを使用しないことを推奨するのはなぜですか?
-
アジ化ナトリウムはHRPの不可逆的阻害剤であるからです。
- 細胞内染色によるサイトカインの染色結果とELISAの結果に良好な相関関係が見られないのはなぜですか?
-
フローサイトメトリーを用いた細胞内染色によるサイトカインの検出は、ある時点でのサイトカイン分泌を示しており、一方、ELISAは時間の経過に伴って蓄積したサイトカインを検出しているからです。
- ELISAキットの感度を教えてください。
-
LEGEND MAX™ kitまたは ELISA MAX™ Deluxe kitの場合、感度については各製品のマニュアルをご覧ください。ELISA MAX™ Standard setの場合、あいにく感度の情報はご提供しておりません。理論的には、別途用意する試薬もすべてBioLegend製品で揃えた場合、対応するELISA MAX™ Deluxe製品の感度と一致するはずです。
- BioLegendのELISAキット製品の品質保持期間を教えてください。
-
LEGEND MAX™ Kitはご購入日から3か月間保証します。ELISA MAX™ Setは、ご購入日から12か月間保証します。ロットごとの使用期限につきましては、各製品の箱のラベルをご確認ください。
- 2種類の基質液、TMB Substrate Reagent Set (Cat. No. 421101) とTMB High Sensitivity Substrate Solution (Cat. No. 421501)の違いは何ですか?
-
TMB Substrate Reagent Set (Cat. No. 421101)は2種類の構成品から成る製品で、使用直前にそれらの構成品を混合する必要があります。TMB High Sensitivity Substrate Solution (Cat. No. 421501) は1種類の溶液で、必要な成分すべてと特殊な安定剤が含まれており、感度が良く、より強いシグナルが得られます。アッセイに使用する基質の種類は、得られるOD値や、目的のOD値を得るために必要な時間に影響を与える可能性があります。
- キットに付属している、スタンダード用のリコンビナントタンパク質をバイオアッセイに使用することはできますか?
-
いいえ、スタンダード用リコンビナントタンパク質を他の用途に使用することは推奨しません。キット製品のスタンダード用リコンビナントタンパク質は、ELISAの標準品として使用するためにキャリブレーションしており、生物学的活性については検証しておりません。また、ELISAのスタンダード用リコンビナントタンパク質には他のキャリアタンパク質が含まれている可能性があります。
- ELISAに組織培養グレードの無菌プレートを使用することは可能ですか?
-
いいえ。組織培養グレードのプレートは細胞・組織培養用に設計されており、通常、タンパク質結合能は高くありません。ELISAでは、Nunc Maxisorp™ plates (Cat. No. 423501)のようにタンパク質結合能の高いプレートを使うことを推奨します。
- ELISAキットに含まれている捕捉抗体や検出抗体を、フローサイトメトリーなど他のアプリケーションに使用することはできますか?
-
ELISAキットに含まれている抗体は、ELISAで使用することを目的として検証した抗体であり、フローサイトメトリーなど他のアプリケーションでの使用に関しては保証しておりません。フローサイトメトリー実験には、フローサイトメトリーで検証した抗体製品を使用することを推奨します。
- ELISAキットで組織サンプルを測定できますか?
-
一般的には、キット製品の反応を阻害しないようにサンプルを調製したのであれば、組織・細胞の抽出液やホモジネートを測定できると考えられます。以下のガイドラインに従ってサンプルを調製することを推奨します。
・組織や細胞は、変性剤(尿素、チオ尿素、SDSなど)を含まない、中性pHのバッファーで溶解またはホモジナイズしてください。
・界面活性剤(SDSやTriton™ X-100など)は加えない、あるいは最小限にするようにしてください。
・過度のイオン強度(生理的イオン強度を超える塩濃度)は避けてください。
・細胞から放出されたタンパク質分解酵素によりターゲットタンパク質が分解されることを防ぐため、バッファーには十分な量のプロテアーゼインヒビターカクテルを加えてください。 - 血清などのサンプルを再利用できますか?
-
サンプルの再利用は推奨しません。正確な結果を得るために、サンプルは分注して保管し、一度だけ使用するようにしてください。サンプルの安定性など多くの要因が結果に影響を及ぼすため、もし、サンプルを再利用する場合には、正確な測定値を得るために追加の検証実験を実施する必要があります。
- ELISA用の抗体ペアを、他社のスタンダード用タンパク質と組み合わせて使用することはできますか?
-
その抗体ペアがELISAキット製品の構成品である場合、異なるELISAキット製品の試薬と組み合わせることは推奨しません。複数のキット製品や他社製品と組み合わせて使用した場合、弊社製品の性能は保証いたしかねます。
抗体を個別に購入し、お客様が独自にELISAの測定系を開発される場合には、使用できる可能性はありますが、試験が必要です。抗体の作製に使用した免疫原の配列や構造がスタンダード用タンパク質の配列や構造と異なる場合、抗体がそのスタンダード用タンパク質を認識しない、あるいは結合が弱くなる可能性があります。 - ELISAを一時中断したい場合、どの段階で止めることができますか?プレートを冷凍保存して、後で使用することは可能ですか?
-
推奨プロトコルに従い、途中で中断せずに実施するのが最善です。しかしながら、実験を一時中断したい場合には、ブロッキングの段階(捕捉抗体を固相化した後)で止めることを推奨します。200 mLのブロッキングバッファーをウェルに加え、プレートを4°Cで一晩保存するか(この場合、シグナルの消失は無いまたは最小限です)、-20°Cで数日間保存することができます(この条件の場合、シグナルに多少の影響が生じる可能性があります)。最初の段階(捕捉抗体の固相化を4°Cで16-20時間以上行う)で一時中断すると、バックグラウンドが高くなる可能性があるため、推奨しません。
- ELISAキット製品の構成品を使い切ってしまったのですが、単品で購入できますか?
-
一部のキット製品の構成品については、単品で購入が可能な場合があります。購入可能かどうかお調べいたしますので、テクニカルサービスへキット製品および構成品のロット番号をお知らせください。
- 異なるELISA MAX™ Setの試薬を混ぜたり、他のアプリケーションに使用することはできますか?
-
そのような使用方法は推奨しません。ELISA MAX™製品の試薬は、特定のロットに対して最適化しています。また、ELISA以外のアプリケーションの使用に関して品質管理試験は行っておりません。
- 捕捉抗体の固相化を一晩よりも長時間行ってもよいですか?
-
一般的には、固相化は4°Cで16-20時間行うことを推奨します。インキュベーション時間を長くすることでプレートに結合する捕捉抗体の量が増加し、その結果、バックグラウンドが高くなる可能性があります。
- 標準曲線の高濃度側にスタンダードを追加して、より高濃度の分析対象物を定量することは可能ですか?
-
そのような方法は推奨しません。キット製品の感度は、個々の構成物およびキット全体としての総合的な検証によるものです。標準曲線に標準点を追加しても変化することはありません。
- 標準曲線の低濃度側にスタンダードを追加して、感度を向上させることは可能ですか?
-
可能かもしれませんが、標準曲線の高濃度側のシグナルがプラトーになる可能性があります。一般的には、ユーザーマニュアルで推奨されている濃度範囲を使用することを推奨します。
- IL-1β ELISA kitはpro-IL-1βと成熟型 IL-1βのどちらを検出しますか?
-
当社のIL-1β ELISA kitで使用している抗体は、成熟型IL-1βを用いて作製しています。しかしながら、IL-1β前駆体タンパク質は成熟型IL-1βを含んでいるため、抗体は前駆体と成熟型の両方を検出すると考えられます。
- 培地に含まれているフェノールレッドは、ELISAを阻害しますか?
-
いいえ。細胞培養用の培地に含まれているフェノールレッドは、ELISAの測定を阻害することはありません。
- ELISAキット製品の中には、血清サンプルをassay bufferで希釈する必要のある製品がありますが、これはなぜですか?
-
サンプルとスタンダードのマトリックスの違いを最小にし、より高い精度を得るために、assay bufferで希釈する必要があります。
- ELISAでより強いシグナルと高い感度を得るにはどうしたらよいですか?
-
・インキュベーション時間を長くしてください(サンプル、検出抗体、avidin-HRPまたはTMB基質)。なお、この場合、バックグラウンドも増加し、感度は高くならない可能性があります。
・インキュベーション中はプレートを振盪してください。
・スタンダード用タンパク質の再調製の際に、完全に溶けていることを確認してから使用してください。
・バックグラウンドを減少させるために、洗浄の回数と洗浄間の浸漬を増やしてください。
・可能であればプレートを副波長(570 nmまたはこれに近い波長)でも読み取り、主波長(450 nm)の値から副波長の値を差し引いて、プレートの傷などによるバックグラウンドを減少させてください。
・ピペッティング誤差を軽減させたり、洗浄バッファーの使用量を多くして洗浄することで、二重測定のCV%を改善してください。
・線形回帰ではなく、5パラメーター(5PL)または4パラメーターロジスティック回帰(4PL)により標準曲線を作成してください。通常、カーブフィッティング用ソフトウェアで作成することができ、標準曲線の下端でもより良い分析を実施できます。 - ELISA KitとELISA Setの違いを教えてください。
-
これらの製品の主な違いは、含まれている試薬です。
LEGEND MAX™: 完全に検証済みの、すぐにお使いいただけるキット製品です。捕捉抗体を固相化した96ウェルストリッププレートを含む、必要な試薬がすべて含まれています。
RAPID MAX™: アッセイ時間を90分未満に短縮したキット製品です。製品は完全に検証済みで、捕捉抗体を固相化した96ウェルストリッププレートが含まれています。
ELISA MAX™ Deluxe: 上記のELISAキット製品より費用対効果の高い選択肢です。いくつかのバッファー類とタイトレーション済みの抗体、スタンダード用リコンビナントタンパク質や基質が含まれています。プレートは含まれていませんので、別途ご購入ください。
ELISA MAX™ Standard:スタンダード用リコンビナントタンパク質、捕捉抗体や検出抗体、Avidin-HRPといった、ELISAの実験系を組み立てるための基本的な構成品のみが含まれています。ある程度の最適化が必要ですが、バッファーやプレートをご自身で準備することで費用を抑えたい方に最適です。
- ELISA MAX™ Deluxe Setにはプレートが付属していますか?
-
いいえ、ELISA MAX™ Deluxe Setにはプレートは含まれておりません。Coating BufferとAssay Diluent(ブロッキングおよび希釈用)は含まれています。プレート(Cat No. 423501)は別途ご注文いただけます。固相化の方法はELISA MAX™ Deluxe Setの製品マニュアルに記載がございます。
- ELISAキット製品に他社の試薬を組み合わせて使用することは可能ですか?
-
そのような使用方法は推奨しません。BioLegendのELISAキット製品は、分析の頑健性を高めるために、試薬濃度やプロトコルを開発および検証しています。試薬(スタンダード用タンパク質、抗体、適切なマトリックス)やプロトコルを変更した場合、最終的にはアッセイの性能に影響を及ぼします。
同じターゲットタンパク質を検出するELISAキットであっても、メーカーにより使用している抗体クローンが異なる場合があります。抗体の特異性によって、検出されるシグナルの強さが部分的に決まります。さらに、スタンダード用リコンビナントタンパク質の発現系や精製方法もメーカーにより異なる場合があります。例えば、大腸菌で発現させたタンパク質は、リフォールディングが均一でなく、異なる免疫反応性を示すことがあります。また、スタンダード用タンパク質はメーカーにより異なる基準で製造および検証しており、異なるキット製品由来の構成品を比較することは困難です。以上の理由により、他社の試薬を組み合わせて使用した場合の性能については保証いたしかねますので、そのような使用方法は避けてください。
- LEGEND MAX™ kitを使用した場合と、他のELISAキットを使用した場合で、サンプルのサイトカイン濃度が異なるのはなぜですか?
-
同じターゲットタンパク質のELISAキットであっても、メーカーにより異なる試薬を使用しており、それらの試薬および抗体クローンの反応性が異なる可能性があるためです。キット製品によっては、サイトカイン濃度が数倍異なる結果となることも珍しくはありません。したがって、異なるメーカーの異なるELISAキットを用いてサイトカイン濃度を比較する場合、pg/mLレベルで全く同じ濃度の結果を得ることは非常に難しいです。
一般的に、特にpg/mLレベルの範囲にあるサイトカインについては、濃度の絶対値が一致することよりも、生物学的な傾向が一致することの方が重要であると考えられます。つまり、あるサイトカインを異なる複数のELISAキットで測定する場合、サンプルへの何らかの刺激に対して、類似したサイトカインレベルの変化パターンを示すはずです。
- 生体サンプル(例えば、正常なヒトや何も刺激をしていない動物の血清)における、特定の分析対象物の濃度はどの程度ですか?
-
サンプルはそれぞれ異なっており、また、サンプル調製や分析対象物の性質に依存する可能性もあり、予測することは難しいです。LEGEND MAX™ Kitをお使いの場合は、製品マニュアルをご確認ください。
- Mini ELISA Plate Reader™をコンピュータに接続できなかったり、ソフトウェアにアクセスできないのですが、どうすればよいですか。
-
Mini ELISA Plate Reader™をmicro-USBケーブルでコンピュータと接続し、装置の電源が入っていることを確認してください。外付けUSBハブは使用せず、装置をコンピュータに直接接続してください。USB接続用のドライバがインストールされていることを確認してください。
- Mini ELISA Plate Reader™には特別な電源が必要ですか?
-
いいえ。製品に付属のmicro-USBケーブルで装置とコンピュータを接続すると、自動的に装置の電源が入ります。
- Mini ELISA Plate Reader™の装置に電源ボタンはありますか?
-
いいえ。付属のmicro-USBケーブルでコンピュータに接続すると、自動的に装置の電源が入ります。
- Mini ELISA Plate Reader™の信号灯が点灯しないのはなぜですか?
-
装置の電源が入っていない可能性があります。Micro-USBケーブルでコンピュータに接続することで、電源が入ります。
- Mini ELISA Plate Reader™のすべての信号灯が同時に点滅しているのはなぜですか?
-
ソフトウェアまたは接続後のセルフテストに関連するエラーの可能性があります。エラーコードと推奨の解決策については、製品マニュアルのトラブルシューティングの項目をご覧ください。
- Mini ELISA Plate Reader™のキャリブレーションに失敗した場合、どうすればよいですか?
-
スロットが空であること、キャリブレーション中にスロット内にマイクロプレートが残っていないことを確認してください。また、スロット内部が汚れていないことを確認してください。Mini ELISA Plate Reader™のクリーニング方法については、製品マニュアルのメンテナンスとクリーニングに関するページをご覧ください。
- Mini ELISA Plate Reader™に使用できるマイクロプレートの種類を教えてください。
-
ELISAに対応している96ウェルのマイクロプレートであればMini ELISA Plate Reader™で使用できます。
- Mini ELISA Plate Reader™用アプリのショートカットを作成する方法を教えてください。
-
インストールの際にプログラムファイルパスに従ってください。アプリのショートカットは、appフォルダにあります。デスクトップにショートカットのコピーを保存することができます。
- Mini ELISA Plate Reader™を用いて定量分析を行う場合、測定後にカーブフィッティング方法を変更することは可能ですか?
-
はい、可能です。保存したデータのファイルを開き、set upから新しいカーブフィッティング方法を適用してください。ソフトウェアが自動的に結果を更新します。
- 定量分析にはどのようなカーブフィッティング方法があるのでしょうか?
-
BioLegendのELISAキット製品の場合、4PL(4パラメーターロジスティック回帰)を使用することを推奨します。他社のELISAキット製品の場合、製品のマニュアルをご確認ください。
- Mini ELISA Plate Reader™で解析する場合、サンプルの希釈倍率はどのように入力すればよいですか?
-
現時点では、アッセイテンプレートの設定中に希釈倍率を入力することができません。データの取得後、手動でサンプルの希釈倍率を適用させることができます。
FAQs
- If I don't have a vacuum, how do I remove the liquid from my plate?
-
If you do not have a vacuum, the assay should be run in a V-bottom plate. After centrifugation using a swinging-bucket rotor with a plate adaptor, you can remove the liquid by flicking the plate quickly, dumping the contents into a sink, and patting it dry carefully on a stack of clean paper towels without losing the beads. Alternatively, you can remove the liquid by using a pipette.
- What are the compatible flow cytometers for the LEGENDplex™ assays?
-
LEGENDplex™ assays can be used on most commonly used flow cytometers that can read APC and PE, such as BD FACSCalibur™, BD FACSCanto™, BD FACSCanto™ II, BD LSR I™, BD LSR II™, BD LSRFortessa™, BD FACSAria™ I, II, III, BD Accuri C6™, BD FACSVerse™, Gallios™, CytoFLEX™, Moflo XDP™, Attune™NxT, NovoCyte™, MACSQuant®, and Guava® easyCyte. Please refer to the “Materials to be provided by end-user” section of your LEGENDplex™ manual for details on the requirements of the machines in terms of laser and channel configurations. For other brands of flow cytometers, the end-user needs to make sure that the machine is set up properly before use.
- Should I perform the assay with the filter plates or with V-bottom plates?
-
Filter plates or V-bottom plates have been included in some kits for your convenience. A vacuum filtration unit is required to work with the filter plates. However, if you don’t have access to a vacuum manifold or if you prefer, then you can use the V-bottom plates and follow the recommended assay protocols for the type of plates you choose. All plates should be made from low binding polypropylene. Polystyrene ELISA or cell culture plates should not be used.
- The kit instruction manual says that the kit is validated for serum, plasma, and culture supernatant sample types. Can I also use tissue homogenates with LEGENDplex™?
-
Yes, all of the above sample types may be used with LEGENDplex™ kits as long as they are prepared in a manner compatible with immunoassays. For tissue homogenate samples, they should be prepared in a neutral pH buffer containing no denaturing chemicals (e.g. SDS, urea, thiourea, cholate, etc.) and no ionic detergents and minimal amounts of non-ionic detergents (e.g. NP-40) may be used in sample preparation. The tissue/cell homogenization buffer should not contain excessive ionic strength above physiological concentrations of salts. If possible, the buffer should also contain protease inhibitors. In addition, the samples should be centrifuged to remove particulates.
- When do I need to do instrument compensation?
-
If a single laser instrument is used for both reporter (PE) and classification (PE/Cyanine5), then compensation is needed to resolve the signal spillover from PE to PE/Cyanine5 and vice-versa. Even on dual laser instruments, some compensation may be required. Please check your machine for the need for compensation. When compensation is required, use the provided calibration beads and follow the Flow Cytometer Setup instructions in the LEGENDplex™ manual. In addition, adjust the PMT voltages such that there is good bead separation, the bead populations are not out of scale, and the PE signal is appropriately amplified to ensure proper signal sensitivity.
- What is the difference between LEGENDplex™ and Luminex® Assays?
-
LEGENDplex™ and Luminex® are both bead-based multiplex immunoassays that use the basic principles of sandwich immunoassays. Both systems use fluorescence-coded beads to achieve multiplexing. The major difference is in the data acquisition. LEGENDplex™ uses common lab flow cytometers for data acquisition, whereas Luminex®-based assays have dedicated machines for this purpose. Therefore, one of the advantages is that LEGENDplex™ can be run on widely available flow cytometers without needing specialized machines. As such, LEGENDplex™ cannot be run on Luminex® machines.
- What curve-fitting algorithm can I use for generating my standard curve?
-
The LEGENDplex™ data analysis software uses a default five-parameter logistic curve-fitting algorithm, which determines sample concentrations and calculates minimum and maximum detection concentrations of the standard curve. If the default algorithm does not work for a particular set of data, other curve fitting methods are available in the software options. If sample concentrations fall outside of the maximum detectable range, the sample will have to be diluted and re-analyzed.
- After I finish the staining process, how long can I wait before reading my LEGENDplex™ samples?
-
The samples can be kept overnight at 4°C while being protected from exposure to light and be read the next day. There may be a decrease in signal, but overall, the assay results should not be affected. Storing the samples for extended periods of time is not recommended, as it could lead to further reductions in signal.
- What is the shelf life of LEGENDplex™ kits?
-
LEGENDplex™ kits are guaranteed for 6 months from the date of receipt, but may have a shelf life of up to 2 years from the date of manufacture.
- Is special software required for data analysis?
-
Typically flow cytometers generate output files in FCS format (e.g. FCS 2.0, 3.0, or 3.1) and in some cases in list mode file format (LMD). Other software may be available to analyze FCS files. Data generated using LEGENDplex™ kits can be analyzed using the freely available LEGENDplex™ data analysis software. Please check our website for the most updated versions of the software.
- My standard curve is not linear; can I use the non-linear part of the standard curve during analysis?
-
Yes. It is possible to use the non-linear part of the standard curve for calculation of results. The LEGENDplex™ data analysis software uses a five-parameter curve-fitting algorithm, which determines the minimum and maximum detection concentrations of each target and reports them. If sample concentrations fall outside of the maximum detectable range, the sample will have to be diluted and re-analyzed.
- Does LEGENDplex™ software run on Macs and PCs?
-
Yes. Our software is compatible with both Macs and PCs. Get more details and download the software at: www.biolegend.com/legendplex/software.
- The biological samples I used in my LEGENDplex™ assay are BSL 2+. Can I fix them prior to flow cytometer acquisition in order to sterilize my samples?
-
The biological samples themselves cannot be fixed before the assay. However, we have found that fixing the beads after the assay with 1-4% paraformaldehyde (PFA) in 1X PBS prior to reading the beads on a flow cytometer is compatible with the assay. Incubation time with PFA should not exceed 10-15 minutes. Prolonged incubation of beads with 1-4% paraformaldehyde will decrease the signal dramatically. Immediately following fixation, the PFA should be washed out using the 1X Wash Buffer supplied with the kit. Beads should be resuspended in the 1X Wash Buffer supplied with the kit.
FAQs
- I am concerned about the spillover I am observing from the Zombie dye into its neighboring channels.
- Rule of thumb with Zombie dyes is to titrate them down as much as possible to fit your application. This should potentially help with spillover. Secondly, Zombie positive events represent dead cells and are typically gated out from analysis.
- How does the performance of your Zombie dye compare with competitors?
-
Zombie dyes have been tested against other leading competitors' fixable viability kits and given comparable results. We also highly recommend that you titrate down the amount of each dye used in order to best match the negative signals of your unstained sample and MFI- (mean fluorescence intensity) stained samples.
- How is your Annexin made and what sequence does it cover?
-
It is made in E. coli, covering human aa Met1-Asp320.
- Why is washing not recommended after the addition 7-AAD or PI addition when assessing viability?
-
These dyes bind in equilibrium with DNA. Therefore, external dye concentration must be maintained during analysis and the dye should not be washed out.
- Can I use methanol/ethanol for fixation after using a Zombie dye?
-
Yes, most fixation reagents are fine to be used with Zombie dyes. However, it should be noted that Zombie dyes can still be sensitive to reactive oxygen species. Light exposure or reagents with hydrogen peroxide can lead to free radical formation, affecting fluorescence.
- Can Zombie be used to determine bacteria, yeast viability?
- We have not tested in house bacterial or yeast viability using Zombie dyes. It is not clear whether the difference between surface and intracellular signals will be significantly different in case of non mammalian cells.
- Can I use Zombie with cells suspension containing serum?
- Serum is full of proteins which will sequester the dye and thereby reducing its effective concentration. The basic rule of thumb with zombie is to titrate it based on your specific condition. Titration also helps reduce the background and spillover into other channels.
- Can I use Zombie dyes for microscopy?
-
Zombie dyes tested in-house for microscopy applications will display data on the product technical datasheet. It should be noted that Zombie dyes may not work for dead cell discrimination in every microscopy application. Important considerations that may impact analysis are determining the signal level that constitutes a dead cell and identifying the proper plane to observe the dead cells.
- Why can't I fix my cells prior to using Zombie dyes?
-
The fixation process can contort and alter the membrane of cells, effectively rendering them dead. Since the ability of the Zombie dyes to stain dead cells is correlated with cell permeability, your results may no longer be a valid representation of dead versus live cells.
- Can I use Zombie dyes to detect apoptotic cells?
-
Yes, Zombie dyes can be used with apoptosis markers, such as Annexin V or Apotracker™ (shown below), to discriminate live, apoptotic, and dead cells.
One day-old C57BL/6 mouse thymocytes were stained with Apotracker™ Tetra Alexa Fluor® 647 and Zombie™ YG581. Zombie-dim/Apotracker™-positive cells are apoptotic, while double-positive cells are dead. Live cells are negative for both markers.
- Can I use the UV laser to stimulate Zombie Aqua™? If so, can I then use it in conjunction with BV510™?
-
While we typically do not test Zombie Aqua™ with the UV laser, its excitation peak suggests it is effectively excited at 355 nm. However, we would not recommend using BV510™ off the violet laser and Zombie Aqua™ off the UV laser at the same time. Due to cross-beam excitation of BV510™ by the UV laser and the violet excitation of Zombie Aqua™, this would lead to significantly increased background and excessive compensation requirements.
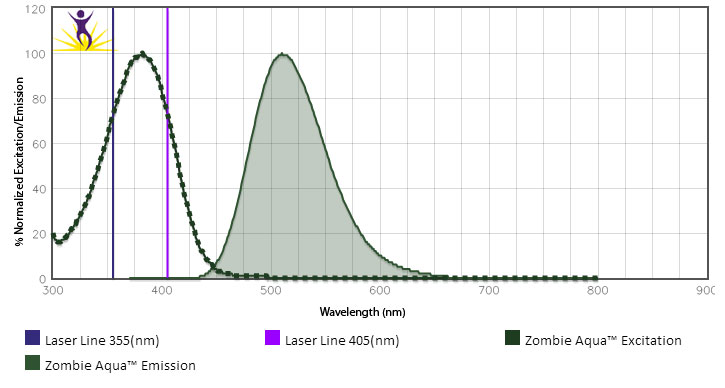
- How should I store Zombie dyes?
-
Store the Zombie dye kit at -20°C upon receipt. Do not open vials until needed. Once DMSO is added, use immediately or store at -20°C in a dry place and protected from light, preferably in a desiccator or in a container with desiccant for no more than one month.
FAQs
- Is there a way to detach your magnetic particles from the cell surface?
-
MojoSort™ Nanobeads: These magnetic particles cannot be removed from cells. This includes standalone Nanobeads and MojoSort kits using Nanobeads. We have found that cells are functional without the need to detach the magnetic Nanobeads.
MojoSort Microbeads: These magnetic particles may be released following the detailed product-specific protocol.
- What is the storage buffer of your particles?
-
The particles are stored in a neutral pH solution containing BSA and sodium azide.
- What is the coating on your magnetic particles?
-
Hydrophilic polymers.
- What is the size of your magnetic particles?
-
MojoSort Nanobeads: the average diameter is approximately 130 nm.
MojoSort Microbeads: the average diameter is approximately 1 μm.
- What is the shelf-life of your magnetic particles?
-
1 to 2 years depending on product type.
- Can your magnetic particles withstand freeze/thaw cycles?
-
Not recommended, however lyophilized particles can be made available as a custom product.
- Are your magnetic particles suitable for use with whole blood?
-
We have cell isolation, selection kits that are pre-optimized for use with whole blood as starting material. In general the MojoSort magnetic particles should be compatible for use in whole blood, but will require optimization.
- Are there any clone restrictions when checking the purity of isolated cells?
-
There are no restrictions for negatively selected cells, as they are untouched by antibodies. For positive selection, there may be clones that are less efficient than others due to possible epitope competition. Please refer to the Technical Data Sheet or contact the Technical Service Group for advice.
- Are downstream applications affected by the magnetic beads bound to the cells?
-
We have tested mouse CD4 positive cells that have been isolated from the spleen and lymph nodes with directly conjugated Nanobeads, as well as CX3CR1 expressing cells from mouse bone marrow. The cells appear unaffected as assessed by migration, differentiation and stimulation assays.
- Can I stain positively sorted cells by flow cytometry?
-
Yes, this is possible, but if you are staining for the same marker as used for sorting, we would recommend using a different clone with non-overlapping epitopes.
- Do your magnetic particles get internalized by the cells?
-
We have not determined this yet.
- Do you provide a custom conjugation service to your magnetic particles?
-
Yes, we do. Please contact our Custom Solutions Team at cst@biolegend.com.
- Do you offer your base magnetic particles (i.e. without any streptavidin or antibody conjugation)?
-
No, not currently.
- Will your magnetic particles separate well in other company's magnetic separation systems?
-
It is possible that other magnetic separation systems can be used. To learn more about this please contact our Technical Service Group.
- What is the composition of your MojoSort™ Buffer?
-
The diluted, 1X MojoSort™ buffer contains 1X phosphate buffer saline (PBS) supplemented with 2 mM EDTA and 0.5% BSA. The 5X solution is sterile. To preserve sterility dilute with sterile water under sterile conditions.
- Are MojoSort™ Nanobeads compatible with other commercially available magnetic separation systems?
-
MojoSort™ magnetic particles can be used with other commercially available magnetic separators, both free standing magnets and column-based systems. Because MojoSort™ protocols are optimized for the MojoSort™ separator, the protocols may need to be adjusted for other systems. Please contact BioLegend Technical Service for more product-specific information and guidance. We do not recommend using MojoSort™ particles for BD’s IMag™ or Life Technologies’ DynaMag™.
- What antibodies are present in the depletion cocktails provided for isolation kits?
-
Please contact our technical service team for further assistance.
FAQs
- What applications can I use epitope tagged antibodies for?
-
The commonly used applications are western blotting, immunoprecipitation and protein purification. These can also be used for immunofluorescence microscopy and flow cytometry.
- Proteins can be detected with anti-protein antibody, but not with the epitope tag antibody. Why?
-
It is likely the target protein was not tagged or the tag is out of the reading frame or the protein is degraded.
- How to set up controls for co-immunoprecipitation experiment?
- For negative control, use an unrelated antibody, or control with the same host species, class, and subclass as the immunoprecipitating antibody. For positive control, use an expression vector with only the epitope tag of interest.
- Where should I put the epitope tag?
- In the literature, the tag has been placed at, or very near, the extreme N or C terminus of the target protein. There are a few reasons behind this choice. Some are historical-like the first proteins to be epitope tagged were tagged at the termini, and when new proteins were tagged it seemed wise to do what had worked in the past. Some of the reasons are practical-tagging is often performed using expression vectors that automatically put the tag at a terminus. And some reasons are theoretical-termini are frequently chosen in the belief that proteins will tolerate additions more readily at these locations than at other sites. While the latter belief may be true-termini are rarely included in active sites, for example-it is also true that many proteins are known for which terminal sequences are critical for function. The termini also appear favorable because they are likely to be on the outside of the folded polypeptide, where one wants the tag to go, and not in the hydrophobic core. But it must be remembered that, due to simple geometry, most of the amino acids in any protein are on the outside, and so, if a protein is tagged at a randomly chosen site, the tag will probably wind up on the outside anyway.
- Will the epitope tag interfere with the function of my protein?
- That has to be determined empirically. However, it is possible that the insertion of the epitope tag may interfere with protein function.
- During Western blot with epitope tag antibodies, there are multiple bands.
-
Several reasons can account for this:
- the early termination of the translation of epitope-tagged protein;
- non-specific detection with anti-epitope tag antibody due to no/poor blocking of the immunoblot.
- partial degradation of the protein
- the concentration of the primary or the secondary antibody is too high.
- Washing between the incubations is not efficient
- How do I introduce the tag?
- The two standard approaches to tagging a cloned gene are: (a) An epitope encoding oligonucleotide is inserted into the coding sequence, or (b) the coding sequence is inserted into an expression vector that already carries the epitope tag. BioLegend does not provide cloning vectors or oligos for cloning. The cloning protocols can be found online or in the literature. When tagging by oligonucleotide insertion, it is important to take into account codon usage preferences for the target cell or organism.
- What are the advantages of Epitope tags?
-
- Tag can be easily and rapidly added to a known gene.
- Multiple tags can be added if required.
- Well-characterized antibodies are available.
- The antibody is specific to the tag, therefore cross-reaction with other proteins is avoided
- Proteins and protein complexes can be purified using standardized practices.
- Tagged proteins can be distinguished from otherwise identical untagged proteins
- Possible to study novel and poorly immunogenic proteins.
- What are the limitations of Epitope tags?
-
A few can be as follows
- A cloned and characterized gene or cDNA must be available
- The epitope tag may interfere with protein structure or function
- Epitope-tagged genes can be expressed at abnormal levels due to the use of heterologous promoters
- The epitope-tagged gene must be introduced into the cell, tissue, or organism of interest.
- Why is there no signal with the epitope tag antibodies on a western blot?
-
A lack of signal following western blotting may indicate a few different problems.
- No or very poor transfer. This can be addressed by quickly checking the membrane with Ponceau-S staining.
- The expression level of the epitope-tagged protein may be too low. Load more ug quantity of the sample and include a positive control.
- A very diluted antibody may be the problem, try a few different concentrations of the antibody to probe the western blot.
- Also, a remote possibility is that the epitope tag is out of frame and is not expressed resulting in a lack of any signal.
FAQs
- Will the prices for former NeoClone products remain the same?
- Yes, BioLegend will not re-price these products. But customers can now use their BioLegend discounts and promotions on former NeoClone products.
- Can I still use the former NeoClone catalog numbers to place my order?
- Customers can find products using the former NeoClone catalog numbers on the website, but all products will be re-assigned a six digit BioLegend catalog number, which will be required for ordering.
- Who do I contact about product questions?
-
Once the products are available on BioLegend's website, contact BioLegend's technical service team for any product questions.
FAQs
- Why choose BioLegend recombinant proteins?
-
• Each lot of product is quality-tested for bioactivity as indicated on the data sheet.
• Greater than 95% Purity or higher, tested on every lot of product.
• 100% Satisfaction Guarantee for quality performance, stability, and consistency.
• Ready-to-use liquid format saves time and reduces challenges associated with reconstitution.
• Bulk and customization available. Contact us.
• Learn more about our Recombinant Proteins. - How does the activity of your recombinant proteins compare to competitors?
-
We quality control each and every lot of recombinant protein. Not only do we check its bioactivity, but we also compare it against other commercially available recombinant proteins. We make sure each recombinant protein’s activity is at least as good as or better than the competition’s. In order to provide you with the best possible product, we ensure that our testing process is rigorous and thorough. If you’re curious and eager to make the switch to BioLegend recombinants, contact your sales representative today!
- What should I reconstitute the protein with? What do you recommend for its long-term storage?
-
Most of our carrier-free recombinant proteins are shipped in liquid form, so there is no need for reconstitution. If you need to make dilutions, refer to the formulation on the product datasheet. Stock solutions should be prepared at no less than 10 μg/mL in buffer containing carrier protein such as 1% BSA or HSA or 10% FBS (for chemokines, use either BSA or HSA). For long-term storage, aliquot into polypropylene vials and store in a manual defrost freezer. Avoid repeated freeze/thaw cycles.
For reconstitution of our lyophilized recombinant proteins (ELISA Std, animal-free, and some carrier-free) please refer to the Certificate of Analysis and/or Technical Datasheet included with the product and follow the instructions. - What is the difference between carrier-free and animal-free categories of recombinant proteins?
-
Our animal-free products are proteins that go through the entire production process without touching any animal containing components. This includes using animal-free media and purification equipment that are animal component-free. Some studies which are particularly sensitive to contamination by mammalian pathogens may require the use of animal-free products. Our carrier-free products do not contain any carrier protein in the solution, as expected, but they are produced using animal-containing components. Both versions are expected to have similar activity and function, though specific activity is lot-dependent.
- What is a carrier protein?
-
BSA is used as carrier proteins to improve the stability of the reconstituted protein, and to avoid the product from sticking to the wall of the vial.
- What is the specific activity or ED50 of my recombinant protein?
-
The specific activity range of the protein is indicated on the product datasheets. Because the exact activity values on a per unit basis can largely fluctuate depending on a number of factors, including the nature of the assay, cell density, age of cells/passage number, culture media used, and end user technique, the specific activity is best defined as a range and we guarantee the specific activity of all our lots will be within the range indicated on the datasheet. Please note this only applies to recombinants labeled for use in bioassays. ELISA standard recombinant proteins are not recommended for bioassay usage as they are not tested for these applications.
- What is the difference between the carrier-free and the non carrier-free recombinant proteins?
-
All our carrier-free and animal-free formats of recombinant proteins do not have any additional carrier proteins such as BSA in the formulation. Typically our ELISA standard recombinants have carrier proteins added to the formulation for added stability and to avoid the product from sticking to the wall of the vial. When the presence of carrier is not desirable (e.g., in-vivo applications), carrier-free proteins can be used directly. When carrier proteins do not affect the outcome in a study, the customer can decide what type of carrier protein they would like to use and whether it is necessary to add it to their stock.
- Can I use different recombinant proteins from different companies for my ELISA?
-
Antibodies used are different in different kits. The specificity of the antibodies partially dictate how much signal is being detected.
Recombinant standards used are different. First of all, different kits may use recombinant proteins expressed and purified using different method. Second, recombinant proteins expressed from E. coli from the same source can show greater than 10 fold difference in term of immunoreactivity from lot to lot, primarily due to refolding inconsistency. Third, different kit standards can be produced and calibrated against different references. So far there is no universally accepted standardization for cytokine immunoreactivities.
Each BioLegend ELISA product was developed and validated with reagent concentrations and protocols optimized for best analytical robustness. Any changes to the reagents (standards, antibodies, matching matrices) and protocols etc all affect the final assay performance. - Have your recombinants been tested for stability?
-
Our testing shows that the recombinant proteins are able to withstand room temperature for a week without losing activity. In addition the recombinant proteins were also found to withstand four cycles of freeze and thaw without losing activity.
- Do you test the bioactivity of your recombinant proteins with in vivo assays?
- We typically validate the activity of the proteins with in vitro assays as described on the data sheet and not with in vivo testing.
- How are BioLegend's carrier-free recombinant proteins shipped?
-
Our carrier-free recombinant proteins are shipped on blue ice. These products have been validated to maintain activity after shipping using blue ice.
- Does specific activity of a recombinant protein vary between lots?
-
Specific activity will vary for each lot and for the type of experiment that is done to validate it, but all passed lots will have activity within the established ED50 range for the product and we guarantee that our products will have lot-to-lot consistency. Please conduct an experiment-specific validation to find the optimal ED50 for your system.
- How do you convert activity as an ED50 in ng/ml to a specific activity in Units/mg?
-
Use formula Specific activity (Units/mg) = 10^6/ ED50 (ng/mL)
- What is the difference between laboratory (observed) units and international units?
-
There is no direct relationship between International Units and the units that are calculated using the inverse of the specific activity because those units are not calculated using the International Standard provided by WHO (National Institute for Biological Standards and control). In those cases, the best way to compare the activity of two sources of recombinants is by doing the bioassay side by side using the same system. If our protein has been tested using the International Standard, the International Units will be indicated on the technical data sheet for that product.
FAQs
- What are possible causes of High Background in my Western Blot?
-
* Transfer buffers may have become contaminated.
* Post-antibody washes may not have been performed with sufficient time or volume.
* Blocking and incubation agents were not freshly prepared or were too dilute. - What are possible causes of No Signal/Poor Signal in my Western Blot?
-
* Transfer efficiency may have been poor. Check protein transfer by staining the gel and/or membrane.
* Incorrect storage of antibodies or ECL western blotting detection reagents.
* Insufficient protein may have been loaded on the gel. Depending on the location of the target protein, membrane or nuclear preparations may be required (instead of whole cell lysates).
* Film exposure time may have been too short. - How much antibody should I use or what titration range you recommend for WB?
-
0.5 μg/ml to 4 μg/ml range can be used for titrations.
- What is your protocol for treatment of your sample prior to generating the web data?
- Please contact technical service for details.
- You say that the antibody is reported for WB and when I read that reference it didn't provide me with details such as antibody usage amount and other protocol details.
- Unfortunately sometimes the published paper may not have all the necessary details about antibody clone usage. It is best to directly contact the authors for more information. It is recommended to consult additional literature to get further details about the protocol and/or particular cell type or experimental situation. Each experiment is unique and so tissue specific validations and titrations are necessary.
- フローサイトメトリーやELISAで使用可能な抗体が、ウェスタンブロットでは機能しないことがあるのはなぜですか?
-
フローサイトメトリーやELISAで使用可能な抗体は、三次元構造のエピトープを認識することによって機能していることがあります。ウェスタンブロットで行われるサンプルを加熱させるような激しい処理により、ターゲットのエピトープが直線化し、抗体によって認識されなくなる可能性があります。
- 抗体の分子量を教えてください。
-
抗体製品の分子量につきましては、社内ではテストしておりません。通常、IgGの分子量はおよそ150 kDです。
- If you have not tested/validated the antibody for WB, why do you claim it works for WB?
- We try to provide additional information such as published literature about a particular antibody clone's compatibility with other reported applications so that end users can make an informed decision before embarking on an experiment. It is recommended to consult additional literature to get further details about the protocol and/or particular cell type or experimental situation. Each experiment is unique and so tissue specific validations and titrations are necessary.
- Why is my actual band size different than the predicted molecular weight?
-
The size of the target protein can be affected by many factors such as:
- Post-translational modification such as phosphorylation, glycosylation can increase the size of the protein.
- Post-translation cleavage - e.g. some proteins may get cleaved to the active form from pro-protein form via post translational cleavage.
- Different sized proteins produced from the same gene can be produced by alternative splicing (Splice variants).
- Overall charge on the protein based on amino acid composition can also affect the protein migration in a gel.
- Strong protein-protein interactions can potentially lead to Multimers thereby leading to the appearance of higher size bands. This is usually prevented in reducing conditions and boiling of the sample before loading to the gel.
FAQs
- You say that the antibody is reported for IHC and when I read your reference it didn't provide me with details like how much antibody to use or detailed protocol.
-
If an antibody is listed as being quality-tested or validated for IHC, we can look up the protocols for you. If this application is reported in literature for IHC, we have not specifically tested the product for this application. It relies on information from publications. Of course, we seek to provide the most updated information on these publications, so we can update our datasheets if the information is incorrect.
- Can I use anti-fade my live cell imaging microscopy?
-
Anti-fade should not be added for live cell imaging as it will deprive the cells of oxygen.
- Can I use GFP expressing cells with Alexa 488 or FITC?
-
No, due to spectral emission overlap you will not be able to distinguish between GFP and AF488/FITC
- Do I need to perform antigen retrieval on my formalin-fixed, paraffin-embedded samples prior to staining?
-
In most cases, this is true. Antigen retrieval helps both the accessibility of the antibody to the tissue and also counteracts the fixation effects on the recognized epitopes. Check the application references for any additional details for IHC or IF experiments.
- Are fluors such as BV570™, BV605™, BV650™, BV711™, BV785™, PE/Cy7, PE/Cy5, APC/Cy7, PE, APC, PerCP, and FITC good for IF?
-
Due to their vulnerability to photobleaching, these fluors are not recommended for IF. Dyes such as Alexa Fluor®, DyLight™, and BV421™ are good alternatives for the IF application.
- Can antibody X be used for immunohistochemistry? What concentration do I use?
-
Typical concentrations of monoclonal antibodies for use in IHC are from 5-25 µg/ml. Polyclonal antibodies can be used at a range of 1-10 µg/ml. We will indicate on the datasheet if an antibody has been tested in-house or published for use in this application. In addition, you can do a lit search with the clone name and immunohistochemistry/paraffin/frozen to see what the protocol details are.
FAQs
- Is there any peptide length recommended?
-
There are no special requirements for the peptides. Peptides that naturally bind to MHC molecules will bind to Flex-T™ reagents. For class I molecules, typical length is about 8 – 10 amino acids. Class II molecules accommodate longer peptides, about 14 – 20 amino acids1.
1) Mohan JF and Unanue ER. Unconventional recognition of peptides by T cells and the implications for autoimmunity. Nat Rev Immunol. 2012 Oct;12(10):721-8. - What are MHC tetramers and what can you do with them?
-
The T-cell mediated innate immune response is defined by the interaction between antigen presenting cells and T cells, through the Major Histocompatibility Complex (MHC) and the T cell receptor (TCR). MHC molecules present a peptide to antigen-specific T cells that recognize this peptide. Soluble, monomeric MHC molecules bind very weakly to the TCR. However, by making a tetramer through a fluorescently labeled streptavidin conjugate, the complex binds to several TCRs, creating a more stable interaction and making it useful for flow cytometric detection of antigen specific T cells.
- I am interested in finding novel peptides instead, are there any resources for this?
-
There are a number of databases and webpages that can help, these are three of them:
- What are the specifications of the UV source?
-
Long-wave UV, 366 nm, 8 Watts (We recommend, for example, CAMAG cat# 022.9115, or Ultraviolet Crosslinker CL-1000). The distance from the solution to the light source should be 2 – 5 cm (approximately 0.8 – 3 inches).
- What is Flex-T™?
-
Flex-T™ (Flexible-Tetramers) is BioLegend’s brand name for our Soluble MHC product line. It encompasses monomers, the ultraviolet (UV) peptide exchange technology, and all associated products and applications.
- Do I need to know the sequence of the UV-labile peptide?
-
The sequence of the UV-labile peptide is not needed to use the reagent. MHC molecules are not stable without a peptide, so these peptides are used just for two purposes: stabilize the MHC molecules and serve as a place holder to be substituted by the peptide of interest.
- Do you offer mouse monomers or tetramers?
-
We offer a selection of fixed peptide mouse monomers within our catalog. We also produce mouse monomers and tetramers as Custom Flex-T™ Reagents.
- Do you offer custom products and services?
-
Yes, please contact our Custom Solution Team with your request at cst@biolegend.com, or contact your local BioLegend representative.
- How do I evaluate the efficiency of the peptide exchange?
-
Follow the protocol for HLA class I ELISA. An assay positive control is provided (Cat#280301) that can be diluted to a high, medium, and low concentration. Signal intensity can be correlated to affinity of the peptide.
- What is the peptide exchange technology and what's the advantage of using it?
-
Flex-T™ MHC monomers are loaded with a peptide that can be degraded by the use of a UV light source. This allows for a peptide exchange when the UV irradiation is done in the presence of the peptide of interest (which is not UV-labile). This flexibility permits the screening of virtually any peptide of interest with enough affinity for the MHC allele that it is loaded onto.
- If I am still interested in "fixed" peptides, what do you recommend?
-
Please see the linked document titled “Peptide Sequences”. The document contains a table with commonly used peptides by allele to study antigen specific T cells.
- Is it feasible to screen not just peptides, but also several specificities of antigen-specific T cells in one sample?
-
With the traditional pre-assembled Tetramer approach, this is difficult to do, and not cost-effective. With Flex-T™ technology, as there is more flexibility to assemble the tetramers, it is easy and affordable to screen a sample for several specificities2. To facilitate this approach, a combinatorial color coding system has been developed. Please visit the Flex-T™ webpage for a detailed description.
2) Hadrup SR et al. Parallel detection of antigen-specific T-cell responses by multidimensional encoding of MHC multimers. Nat Methods. 2009 Jul;6(7):520-6. - Is there any advantage in buying biotinylated monomers?
-
Yes, the same monomer can be assembled with different Streptavidin conjugates, providing great flexibility for color choices. Additionally, it can be stored frozen and the tetramer assembled shortly before the experiment. This increases the storage time of the reagent.
FAQs
- Is RNA from Veri-Cells™ able to be used for analysis, for example RT-PCR or RNA flow?
- We have not tried this yet, but it may be possible.
- Is washing required after staining?
-
Yes, it is recommended to wash after staining. We recommend using BioLegend's Cell Staining buffer (Cat. No. 420201) for the wash step.
- How much antibody should I use to stain Veri-Cells™
-
Depending on application pursued it may require diluting the antibodies prior to use.
- What is the expected percentage of CD3+ cells?
- This information is provided in the COA for each lot, it would be similar to what you would see in the “normal” population.
- Can you freeze the cells after reconstitution?
- We do not recommend freezing the cells after reconstitution.
- Can they be used for functional assays?
- This will not work, since the cells are not viable.
- Can the buffer included with the cells be used to keep thawed PBMCs alive?
- We have not tried this.
- Can the cells be activated after rehydration?
- No, they cannot be activated.
- Are these cells virus/pathogen free?
- These are tested to be free of HIV, HBV, syphilis, and HCV.
- Are there any RBCs in Veri-cells™?
- There may be a few, but the majority of RBCs are not present in Veri-Cells™ preparations.
- Are these cells viable?
- No they are not.
- Can a constant percentage of each population be expected in each lot?
- Yes, within each lot, cell populations remain constant.
- Are the cells fixed?
-
They are treated with our proprietary mixture prior to lyophilization.
- Can I treat this like any other sample of PBMCs?
- Yes, make sure to use the Reconstitution buffer for the staining.
- Do Veri-Cells™ stain 100% positive for 7-AAD/DRAQ7?
- Yes.
- Can the cells be used for T or B cell sorting using magnetic bead isolation?
-
Yes, it should be possible, although this has not been verified by BioLegend.
- Can they be used to detect intracellular cytokines such as TNF-α or IFN-γ?
-
For this, use Veri-Cells™ Activated (Cytokine) PBMC which have been activated with Cell Activation Cocktail (with Brefeldin A) containing PMA and Ionomycin. These have been validated to stain positive for activation-induced cytokines including TNF-α and IFN-γ. Veri-Cells™ PBMC and Veri-Cells™ CD4-Low PBMC will not have detectable TNF-α or IFN-γ.
- How do we QC these cells?
-
Each Veri-Cells™ product is tested with a panel of antibodies to ensure expression of these markers falls within the expected range. For more information regarding the exact markers used for each product, please contact technical service.
FAQs
- I have phosphate in my enzyme. What can I do?
-
You can dialyze or desalt the enzyme into a phosphate-free buffer.
- I have 5% DMSO in my assay. Can I use PhosChrome™?
-
Yes, the reagent is designed for drug screening work and other situations that require DMSO.
- Why do I get a high background when my enzyme definitely has no free Pi?
-
This is almost certainly caused by inadequate mixing of the Stabilizer. This results in a high background signal because of non-enzymatic decay of ATP substrate. The Stabilizer is added in a relatively small volume (20μL), and the operation of pipetting up and down with a pipette set to 20μL volume may not result in sufficient mixing when the total volume is 270μL. Try pipetting up and down while stirring at the same time. Alternatively, add the Stabilizer with one pipette set at 20μL volume and mix using a larger pipette set to ~150μL volume. This ensures thorough mixing of the Stabilizer solution with minimal effort.
FAQs
- How do I know if my chromatin has been sheared?
-
Purify the DNA from your sheared chromatin samples and run the DNA on a 1-2% agarose gel. DNA should be sheared to a range of 100-900 bp. Below is an example of chromatin from a number of different cells lines that has been sheared optimally using enzymatic digestion compared to chromatin which was over-digested.


Lane 1: Ladder, Lane 2: HeLa, Lane 3: Jurkat, Lane 4: NCCIT, Lane 5: HeLa IL-6 Lane 1: HT1080+ IFNγ, Lane 2: NIH353, Lane 3: HT29, Lane 4: HCT116, Lane 5: Ladder - Which points in the protocol can I stop and save my experiment?
-
Sheared chromatin may be saved at -80°C prior to performing the immunoprecipitation. If you are saving the chromatin, we would recommend aliquoting the chromatin as it can be sensitive to freeze thaw cycles. Alternatively, purified DNA can be saved prior to downstream analysis.
- Should I use sonciation or enzymatic shearing?
-
Sonication may be ideal for difficult to lyse cell types and provides random fragmentation but may damage epitopes. It is not suitable for Native ChIP experiments (in which the chromatin has not been cross-linked). Enzymatic digestion is milder and can be used in Native ChIP experiments but will exhibit sequence bias and may not be suitable for hard to lyse cells.
- What cell types have been validated with the Go-ChIP-Grade™ kit?
-
Human and mouse cell lines such as HeLa, Jurkat, Daudi, THP-1, NIH3T3, and 293T have been validated using this protocol. Other cell types (plant, yeast, tissue, FFPE samples, etc.) may require optimization.
- How do I determine optimal number of cells for ChIP assay?
-
An important consideration when performing ChIP is the amount of chromatin that will need to be loaded to the column in order to elute sufficient IP’ed DNA for downstream analysis. Sufficient cell numbers should be used so that at least 3µg of chromatin can be used per IP. Start with 1-15 million cells. However, the cell number can be scaled up and the reagents need to be adjusted accordingly.
- How much antibody for target protein should be used per ChIP?
-
This should be determined empirically by the end-user. Refer to the datasheet for our Go-ChIP-Grade™ Purified Antibodies, or other ChIP-validated antibodies. The suggested dilution of the Go-ChIP-Grade™ anti-RNA Polymerase II Antibody; Clone 8WG16 (positive control) is 1:300 – 1:500 by volume.
- What is causing high background?
-
The quality of the ChIP antibody has a major impact on the success of the assay. Use only ChIP-validated antibodies. Make sure to have good quality chromatin samples with fragments between 150-900bp. Insufficient DNA shearing leads to longer DNA fragment length that can cause high background in downstream experiments. Insufficient wash steps can also leave traces of non-specific chromatin alongside enriched DNA. If background remains high, include an additional wash step during the IP protocol.
- Why do I not have any enrichment?
-
Make sure to only use ChIP-validated antibodies and follow the instructions for the amount of antibody to be used or titrate the antibody for your experiment. It is also recommended to include ChIP validated positive and negative controls (included in the kit) to validate the efficiency of your ChIP assay. Good quality chromatin samples and chromatin fragment sizes between 150 – 900 bp are also critical. Other factors can include whether cells were effectively lysed, over-fixation and reduced antibody binding due to decreased epitope availability, and insufficient starting material (chromatin sample per IP).
FAQs
- TotalSeq™試薬とは何ですか?また、CITE-seqやREAP-seqのような確立されたワークフローにおいてどのように機能しますか?
-
TotalSeq™はオリゴヌクレオチドを標識したBioLegendの抗体製品で、1細胞レベルでタンパク質とmRNAを同時に解析することが可能になります。CITE-seqとREAP-seqはタンパク質とmRNAを同時に解析するための、類似したワークフローです。TotalSeq™製品はこれらの確立されたプロトコルに円滑に統合できます。
- TotalSeq™-A、-Bおよび–Cの違いは何ですか?
-
3種類のフォーマットの主な違いは、標識されているオリゴヌクレオチド配列と、対応するプラットフォームです。
- TotalSeq™-Aは、10x Genomics社の 3’ Single Cell Gene expression kitを含む、捕捉にpoly-Aを用いる方法(機器に依存しない)に対応しています。
- TotalSeq™-Bは、Feature barcodeテクノロジーを使用している10x Genomics社の3’ Single Cell Gene expression kitに対応しています。
- TotalSeq™-C は、Feature barcodeテクノロジーを使用している10x Genomics社の5’ V(D)J expression kit用の製品です。これらの製品は、ライブラリー増幅のためにそれぞれ異なるプライマーを使用します。違いに関する詳細はTotalSeq™ ウェブページをご覧ください
- TotalSeq™-Aと-Bを一緒に使用できますか?
-
同一の実験でTotalSeq™-A製品とTotalSeq™-B製品を混合して使用することに関して、当社では保証いたしかねます。これら2種類の製品は、ライブラリー調製にそれぞれ異なるプロトコルを必要とします。また、捕捉方法が異なることで捕捉効率に差異が生じる可能性があります。さらに、インデックスシーケンスと長さが異なることにより、バイオインフォマティクスによるデータ解析の際に問題が頻繁に発生する可能性があります。理論的にはこれらを一緒に使用できるように思われますが、実際のところは非常に困難な場合があるので、できる限りそのような使い方はしないことを推奨します。
- 10x Genomics社の3’ Single Cell Gene ExpressionにTotalSeq™-Aを使用できますか、それともTotalSeq™-Bを使う必要がありますか?
-
どちらでも問題なくお使いいただけます。
- “features”とは何ですか?
-
1細胞解析のデータについて検討する場合、"features"は測定する細胞のあらゆる特徴を意味します。一般的な"features"としてはmRNA、タンパク質、sgRNAなどです。
- TotalSeq™-A、BおよびC製品は10x Genomics社によるサポートを受けることができますか?
-
TotalSeq™-A、BおよびC製品は、10x Genomics社のプラットフォームを用いてBioLegend社内において検証しており、BioLegendによる保証の対象です。また、TotalSeq™-BおよびC製品を用いた場合は10x Genomics社のサポートの対象です。TotalSeq™-A製品の場合、10x Genomics社によるサポートは限定的となります。
質問がある場合、あるいは何か問題があるがどちらのテクニカルサービスに問い合わせればよいか分からない場合は、BioLegendにお問い合わせください。当社のパートナー企業と協力して問題解決に取り組み、また技術的なご質問にお答えします。
- Hashtagとは何ですか?
-
Hashtag試薬はサンプルにバーコードを付加するために使用します。これにより、複数のサンプルを混合して1つのレーンに加えることができ、データ解析の際にde-multiplexすることが可能となります。Hashtag試薬はヒトまたはマウスの細胞に特異的で、可能な限り多くの細胞を認識できるよう設計しています。ヒトサンプル用のHashtag試薬は、普遍的に発現している細胞表面マーカーCD298とβ2 microglobulinをそれぞれ認識する、2種類の抗体の混合物です。それぞれの抗体はバーコード配列を含む同一のオリゴヌクレオチドが標識されています。マウスサンプル用の場合、使用する細胞表面マーカーはCD45およびH-2 MHC class Iです。これらの標識抗体は既に混合してあるので、すぐに使用できます。
- Cell hashingの利点は何ですか?
-
Hashingを利用することで、10x Genomics社のChromiumまたは同等機器の単一レーンに複数のサンプルを流すことができ、同時に解析できる細胞数やサンプル数を最適化することができます。これにより、バッチ効果やサンプルの取り扱いによる変動を減少させることができます。また、ダブレットをより効率的に識別することが可能です。さらに、1サンプルの細胞数が少ない場合に複数サンプルを混合することで、1レーンに流す細胞数を増加させ、収量を向上させることもできるので、使用するプラットフォームとプロトコルの最適化にも役立ちます。
- "Super loading"とは何ですか?
-
通常、細胞区分用プラットフォームを使用する場合、流す細胞数を増やすとダブレット(単一のデータポイントに細胞が2個含まれている状態)の割合が増加します。これにより、含まれている細胞数が1よりも多いデータポイントの割合が許容範囲を超えてしまいます。Hashtag製品を用いると、多数の細胞を流すこと(super load)ができます。これを行うためには、まず、同一サンプルを複数に分注します。その後、分注したサンプルをそれぞれ異なるHashtag抗体で染色し、最終的にはこれらのサンプルを混合します。分注後のサンプル数や分注後の細胞数には差があるかもしれませんが、染色後に洗浄したサンプルを混合し、解析の結果、2種類以上のHashtagが1細胞のデータイベントにおいて検出された場合、そのイベントはダブレットとして安全に破棄することができます。この方法は同一のHashtagで標識された2細胞以上のダブレットを除去することはできませんが、ダブレットの検出率は大幅に増加します。しかしながら、流す細胞数を増やすほどダブレットが起こりやすくなり、その結果として解析に利用できるデータポイントが少なくなる可能性があるので、"Super loading"を行う際には慎重にコントロールする方がよいでしょう。複数サンプルの最適化、1細胞データの量、そして機器のパフォーマンスの間でバランスが取れているようにしてください。
- Nuclear hashtagとは何ですか?
-
Nuclear hashtagは単一核RNA-seq (snRNA-seq)用サンプルに用いられます。snRNA-seqでは核から単離したRNAを捕捉します。snRNA-seqは、特定の実験条件あるいはサンプルの状態のために損傷していない全細胞を分離することが難しい場合や、特定の科学的な疑問について調べる場合に行われます。Nuclear hashtagを用いるアプリケーションについてはこちらの論文をご覧ください。
https://www.nature.com/articles/s41467-019-10756-2 - single cell ATAC-seqにnuclear hashtagを使用できますか?
-
残念ながら、現時点では当社のTotalSeq™製品はscATAC-seqキットに直接は対応しておりません。しかしながら、NYGCではTotalSeq™抗体をscATAC-seqなど他の捕捉方法によるプラットフォームと組み合わせて使用できる、ATAC with Select Antigen Profiling by sequencing (ASAP-seq) を開発しました。
https://www.biorxiv.org/content/10.1101/2020.09.08.286914v1Nuclear hashtag製品を販売中ですが、現時点では、このアプリケーションに推奨できるプロトコルは当社にはございません。ご紹介できるのは次のような文献です。
https://www.nature.com/articles/s41467-019-10756-2 - Hashtag製品を使用した場合に、テクニカルサポートを受けることはできますか?
-
Hashtag製品は10x Genomics社のプラットフォームを含むすべてのシングルセルプラットフォームで使用可能で、BioLegendはHashtag製品の使用に関してサポートします。詳細はテクニカルサービスへお問い合わせください。
- フローサイトメトリー用抗体とTotalSeq™抗体を共染色した場合、ワークフローに影響しますか?
-
当社では検討していませんが、同じターゲットに対する抗体クローンで互いに競合しないクローンであれば問題にはならないと考えられます。同様に、同じターゲットに対する両方の抗体が亜飽和濃度であっても、細胞や技術によって許容されるはずです。StoeckiusらによるCITE-seqの論文(Fig. 2)では、下流の解析のために細胞を共染色できることが示されています。著者は現在のTotalSeq™試薬を使用していませんが、技術的には同じです。さらに、CITE-seqを行った他の研究者によってもこの方法が実証されています。詳細についてはテクニカルサービスにお問い合わせください。
- CITE-seq用にサンプルを処理する前に、死細胞を除去することが必須なのはなぜですか?
-
CITE-seq実験を開始する前に、細胞の生存率が95%を超えている状態であることを推奨します。死細胞が多く含まれている状態でCITE-seq実験を実行すると、1細胞ずつ区分する過程で死細胞も含まれてしまうことになり、その過程において無駄が生じます。さらに、最適化されていないデータが最終的に生成されてしまう可能性があります。また、標的とする細胞の頻度が非常に低い場合に、ポジティブイベントを取得するために十分な数の細胞を処理できない可能性があります。なお、死細胞は磁気ビーズを使用して除去することもできます。死細胞を除去する前にCITE-seq実験を実施する必要がある場合には、バイオインフォマティクスの手法を用いて低品質のイベント(死細胞を含んでいる場合があります)を除去できるかどうか試してみることもできます。これはより複雑な方法になる可能性がありますが、検討する場合には次の文献を参照することを推奨します。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4758103/
https://www.ncbi.nlm.nih.gov/pubmed/28045081 - CITE-seqの前にサンプルをソーティングする必要はありますか?事前にソーティングするかどうかを決める際に、考慮する方がよい点はありますか?
-
目的の細胞集団をソーティングすることなくクラスタリングし識別できる場合には、事前にソーティングが必要な可能性は最小限であると考えられます。しかしながら、クラスター内の細胞数が非常に少ない場合は、コントロールや他の細胞集団と比較して結論を出すには十分ではないかもしれません。そのような場合、CITE-seqの前に目的の細胞集団を濃縮しておくことで、目的の希少細胞集団に選択的な、より有意義なシーケンスデータを取得するのに有用である可能性があります。また、サンプルの細胞の生存率が95%未満の場合には、死細胞を除去することを推奨します。
- TotalSeq™抗体の至適濃度を決定するにはどうすればよいですか?
-
抗体の条件検討を行う場合には、次のような方法でご検討ください。
1. 実際のCITE-seqの方法を用いて条件検討を行うのはコストがかかりますが、Hashtag製品を使用することで、コストを抑えて実施することができます。詳細についてはこちらの文献のFig. 3と関連する方法をご覧ください。
2. 同一クローンのPE標識抗体を用いてフローサイトメトリー実験を行い、最適な抗体濃度を調べます。フローサイトメトリーで用いた抗体濃度をCITE-seqでも同様に使用します。
3. TotalSeq™抗体の濃度を振って細胞を染色し、その後、TotalSeq™抗体を検出するための二次試薬としてAlexa Fluor® 647などの蛍光色素を標識したpoly (dT)オリゴを反応させます。これはより直接的な方法ですが、実際のTotalSeq™抗体を使用する必要があります。
また、複数の抗体を組み合わせて使用したい方のために、条件検討済みの抗体を凍結乾燥したTotalSeq™抗体カクテル製品を開発しました。これらの抗体カクテル製品は3種類のフォーマット(TotalSeq™-A、 B、およびC)をご用意しており、主要な免疫系細胞を特定するために設計した製品と、130種類のタンパク質に対する抗体と7種類のアイソタイプコントロールを含むuniversal panel製品があります。このアプリケーションのために数十種類もの抗体の条件検討を行うことは容易な作業ではありませんので、今後もこのようなタイトレーション済みの抗体カクテル製品を開発および販売していきます。なお、個別の抗体における至適濃度は複数の要因に依存しますので、各抗体の推奨使用濃度範囲の条件をご提供できない場合もございます。予めご了承ください。
- データ分析にはどのようなツールを利用できますか?
-
利用可能なツールにはCITE-Seq-CountやRahul Satija laboratoryによって開発されたツールが含まれます。詳細についてはテクニカルサービスにお問い合わせください。
- プライマーはどこに注文し、純度はどのようにする必要がありますか?
-
プライマー合成を提供している会社は数社あります。例えば、IDT technologiesもお勧めできる会社の1つです。純度に関しては、additive primerの場合、脱塩精製で十分です。Index primerの場合、HPLCまたはPAGE精製が必要です。
- mRNAとは別にADT/HTOライブラリーを作製するのはなぜですか?
-
ADT/HTOライブラリーとmRNAライブラリーを分けて作製することで、より柔軟にシーケンスの条件を設定できます。必要なリード数に応じて、シーケンスの前にライブラリーを様々な比率で混合することができます。通常、ADT/HTOライブラリーは対応するmRNAライブラリーと比べて、必要なシーケンス深度が少ないです。
- 抗体とターゲットタンパク質の結合を阻害しないように、どのようにオリゴヌクレオチドを抗体に標識していますか?
-
オリゴヌクレオチドは、ある蛍光標識抗体で使用されている方法と同じ方法で抗体に標識しています。オリゴヌクレオチドの標識後に、その抗体がまだターゲットへ結合できることをフローサイトメトリーで確認します。これはTotalSeq™抗体の品質管理過程の一部です。
- CyTOF®とTotalSeq™ (CITE-seq)を並行して実施することは可能ですか?
-
CyTOF®は独自の機器とプロトコルが必要であり、実験の過程でサンプルが壊されるので、CyTOF®とCITE-seqを同時に行うことはできません。並行して実施したい場合には、サンプルを分けてCyTOF®とCITE-seqの両方の解析を実施する必要があります。なお、CITE-seqはCyTOF®と同様に細胞表面タンパク質のデータを取得することでき、はるかに多くの項目を1細胞レベルで解析できます。
- CITE-seqを拡張してマイクロRNAを検出することは可能でしょうか?
-
マイクロRNAは非常に小さく、多くの場合、CITE-seqに必要なプライマーと同程度あるいはそれよりも小さいです。したがって、技術的に困難であり現時点では不可能だと考えられます。
- TotalSeq™をバルクRNA-seq実験で使用できますか?
-
はい、使用できます。Bulk epitope and nucleic acid sequencing (BEN-seq)を行うためのプロトコルはイルミナ社とBioLegendが共同開発しました。詳細はアプリケーションノートをご覧ください。
- フローサイトメトリーのように、自家蛍光が問題となりますか?
-
いいえ。最終的な読み出し結果であるシーケンシングは、細胞の自家蛍光の影響を受けません。
- TotalSeq™による標識を介してタンパク質発現を検出するための基準値となるコピー数はいくつですか?
-
これは主に抗体の親和性やタイトレーション、および抗原の発現レベルと関係しています。BioLegendは共同研究者と共にタイトレーションデータについて検討しており、いくつかのデータは既に論文として報告されています。理論的には抗体がターゲットタンパク質1分子に結合さえすれば、PCRによる増幅とシーケンシングによってそれを検出できるはずですが、常にバックグラウンドノイズが存在します。これを管理する一般的な方法は、陰性細胞を実験に追加することです。例えば、ヒトのPBMCを解析する場合、マウス細胞を使用します。その逆もまた同様です。
- 実験に必要な細胞数はどのくらいですか?
-
これは、どのようなことを調べたいのかによって異なります。技術的観点から考えると、10x Genomics社のChromiumを用いる場合、1レーン当たり5,000から10,000個の細胞をロードすることを推奨します。Hashtag製品を使用することで、その数を増やすことができます。なお、抗体反応の際の作業を容易にするため、通常1,000,000個の細胞を準備することを推奨していますが、この数は細胞をどのくらい入手できるかという点と、作業する人が細胞数の少ないサンプルを扱うことに長けているかという点にも依存します。
- 同時に何種類のTotalSeq™抗体を使用できますか?
-
当社ではいくつかの抗体カクテルを既に最適化しており、Human TBNK cocktail (TotalSeq™-A, -Bまたは -C)は9種類の抗体、TotalSeq™-C Human Universal Cocktail, v1.0の場合は130種類というかつてないほど多くの抗体と7種類のアイソタイプコントロールが1本のバイアルに含まれています。近い将来、さらに多くのパネルをリリースする予定です。なお、これまでに報告された論文によると、さらに多くの抗体を同時に使用できることが示唆されています。例えばYapengらのグループは197種類のTotalSeq™抗体と7種類のアイソタイプコントロールを使用した研究を発表しました。シーケンシングによるタンパク質の同時検出可能数はその上限が増え続けており、現時点では同時に最大何種類までのTotalSeq™抗体を使用できるのか不明です。
- 細胞をオリゴヌクレオチド標識抗体と蛍光標識抗体の両方で同時に染色した後、最初にフローサイトメーターでソーティングし、それからCITE-seqを行うことは可能ですか?オリゴヌクレオチド標識はソーティングに耐えられるのでしょうか?
-
オリゴヌクレオチドはソーティングに耐えられるはずです。しかしながら、理論的に考慮すべき事項として、フローサイトメトリーやシーケンシング結果への影響を最小限に抑えるために、競合しないクローンの抗体を用いることを推奨します。レーザーに照射されるのは非常に短時間であると思いますが、当社ではオリゴヌクレオチド標識抗体に対するUVレーザーやバイオレットレーザーの影響は検証しておりませんので予めご了承ください。なお、ソーティングの代替手段として、MojoSort™のような磁気ビーズを用いたネガティブセレクションも可能です。
- ADT/HTOライブラリーのシーケンス深度はどのくらいにすればよいですか?
-
シーケンス深度として5,000 reads/cellを推奨します。もし100種類以上のTotalSeq™抗体をお使いの場合は、10,000 reads/cellに増やす方が良いでしょう。HTOライブラリー単独の場合には500 reads/cellで十分です。
- アイソタイプコントロールは必要ですか?
-
アイソタイプコントロールの使用を強く推奨しますが、必須ではありません。これらのアプリケーションにおけるアイソタイプコントロールの有用性は、生存率の低下により粘着性が高くなった細胞を特定できるという点にあります。また、アイソタイプコントロールによりバックグラウンドレベルや異なる細胞種の非特異的結合の全体像も得られます。通常、CITE-seq実験でアイソタイプコントロールを使用する場合には、バネルに含まれている抗体の数に関わらず、パネルに含まれているすべてのアイソタイプに対してアイソタイプコントロールを1種類ずつ加えるようにするのがよいでしょう。その時のアイソタイプコントロールの濃度は、パネルに含まれている同一アイソタイプの抗体の中で最も濃度が高い抗体に合わせることをおすすめします。また、アイソタイプコントロールはパネルの抗体と同じチューブの中で使用します。従来のフローサイトメトリー実験とは異なり、マルチオミクス実験におけるアイソタイプコントロールは、比較のためにアイソタイプコントロール用の個別サンプルやチューブを必要としません。TotalSeq™ Universal Cocktails製品の場合、アイソタイプコントロールは既にカクテル中に含まれています。
陽性シグナルを特定するために有用なその他のコントロールとしては、解析で使用する抗体が結合しないことが分かっている細胞が考えられます。例えば、ヒトのサンプルを解析する場合で、用いる抗体がマウスには交差しないことが分かっている場合、マウス細胞をコントロール用細胞とすることができます。しかしながら、このようなコントロールは陽性シグナルを明確に識別するために必要なものではありません。
- ブロッキングに硫酸デキストラン(dextran sulfate)を使用する方がよいですか?
-
10x Genomics社のプロトコルを含むいくつかのゲノミクス関連プロトコルには、核酸と正に荷電した他の分子との相互作用を防ぐために、阻害剤として硫酸デキストランを加えることを推奨しているものがあります。しかしながら、硫酸デキストランの存在下では抗体の認識と結合が阻害される場合があることが明らかになっています。したがって、TotalSeq™製品を使用する場合には硫酸デキストランの使用を避けることを推奨します。このような問題を引き起こす作用機序については不明です。当社のすべてのプロトコルはこの見解を反映させています。硫酸デキストランの使用はお控えください。
- TotalSeq™ Universal cocktailにさらにTotalSeq™抗体を追加できますか?
-
はい。再調製した抗体カクテルに、個別の抗体を追加することができます。抗体の追加に関して当社が推奨するガイドラインやその他の考慮すべき事項につきましては、テクニカルサービスにお問い合わせください。
FAQs
- サンプルの一部に異常なシグナルが検出されました。この原因は何でしょうか?
-
フローサイトメトリーや顕微鏡解析でよく使用される蛍光色素の中には、ポリエチレングリコール(PEG)基が組み込まれているものがあります。また、多くの人々の血液中には、検出可能なレベルの抗PEG抗体が含まれています。これらの抗PEG抗体は、特定の濃度で蛍光標識抗体と複合体を形成し、全血を用いて洗浄を行わない方法の解析で異常なシグナルを引き起こす可能性があります。2021年初頭より、全血とPEG化した標識抗体を用いる解析において、異常なシグナルを示すドナーの頻度の増加が観察されるようになりました。予備実験データによると、ドナー集団における抗PEG抗体の頻度および抗PEG抗体レベルが、異常なシグナルと相関関係があることが示唆されています。2021年初頭から広く投与されている新型コロナウイルスワクチンの中には、その成分にPEGが含まれているものがあります。もし、全血を用いる解析を行う場合、そのようなドナー由来のサンプルがあるかもしれません。抗PEG抗体による問題を解決するためには、単純に洗浄ステップを追加するか、ブロッキングバッファーを使用するといったプロトコルの調整を行うことを推奨します。詳細はテクニカルノートをご覧ください。
- The Brefeldin A solution freezes at 4°C . Is the solution still OK?
-
We recommend to thaw in warm water after removing from the fridge. The Brefeldin A is dissolved in DMSO, which freezes at 18°C, so this is normal. No one has reported any problems with the freeze/thaw cycles and this is how we recommend it is stored. If customers are concerned, they can aliquot the Brefeldin A to avoid the freeze thaw.
- How long can I store an antibody after I have diluted it?
-
We would not recommend extended storage of the product after dilution. It is best to prepare the dilution as needed on the day of use. Because there are no preservatives in these buffers and they could be susceptible to changes in pH, long term storage greater than a day or two is not recommended.
- When do I use FluoroFix™?
-
FluoroFix™ (cat# 422101) is designed for fixation of cells stained with fluorescent labeled antibodies, including tandem dyes.
- Why do I need to use Annexin V Binding Buffer?
-
Annexin V binding requires the presence of calcium in the solution. So, we provide Annexin V Binding Buffer (cat # 422201), which is optimized for the best performance of Annexin V staining.
- What is the concentration of the 1000X Brefeldin A Solution (420601)?
-
Brefeldin A is provided at a 5mg/ml concentration.
- What is the concentration of the 1000X Monensin Solution (420701)?
-
Monensin is provided at a 2mM solution.
- Can I keep my stained cells in your FluoroFix™ Buffer (422101) for many days before acquisition?
-
Keeping stained cells in any fixative for longer periods of time is not recommended. You can use Fluorofix™ buffer as recommended on the data sheet, followed by washing with cell staining buffer and then at the last step, resuspend your fixed cells in cell staining buffer till you acquire your samples in a day or two.
- FOXP3染色用のキット製品を使用して、全血を染色できますか?
-
そのような使い方は推奨しません。この染色にはPBMCを使用することが望ましいです。
- How do I choose monensin or Brefeldin A solution?
-
Generally, Brefeldin A is more toxic for longer term incubations, so for shorter stimulations (6 hrs or less) use Brefeldin A. For longer stimulations use monensin. We recommend optimization for each cell type and protocol.
FAQs
- If I don't have enough cells and use much less than 4 million/mL (~ 3 x 105 cells/well), will it still work?
-
This may work with lower numbers of total cells, but we recommend trying to keep higher concentrations of cells for faster analysis. Of course, how many cells are needed depends on the specific application. Successful staining has been done with 1 x 105 cells/well.
- What are the guarantees regarding the lyophilized plate compared to the reconstituted plate?
-
Lyophilized product has a guaranteed shelf life of 6 months unopened. Reconstituted plates can be used or stored at 2 - 8°C sealed in the dark and used within a month. Be sure to properly seal the plates to prevent evaporation and shield the antibodies from light.
- How should the kit be stored?
-
The kit should be stored at 2 - 8°C upon receipt. Once opened, the plates must be reconstituted immediately. Reconstituted plates can be used or stored at 2 - 8°C sealed in the dark and used within a month.
- I have added my own antibody solution to the lyophilized product, will the lyophilized antibody work?
-
Yes, as long as the fluorophores on these antibodies are compatible and proper compensation has been applied during acquisition and analysis.
- I am not going to use all the reconstituted antibody solution. Can I keep the left over for later or re-dry the solution in dark?
-
The antibody is in a one test per well format. There will not be any antibody left if the full test is used. Customers may decide to use less than the recommended volume per test, but this is not recommended and the performance is not guaranteed. Customers may also selectively transfer certain antibodies from the original plate to a new plate and use after reconstitution. If any antibody is not used after reconstitution, the plate can be sealed and store at 2 - 8°C for a month in the dark. Once reconstituted, re-drying is not recommended as this may result in a loss of signal.
- Can I use my existing institution discount for this new product?
-
Yes.
- Can I use half or less of the plate and keep the rest for later?
-
Yes. Customers can use half of the plate or whatever specificities they are interested in. However, the whole plate should be reconstituted. The half plate of antibodies must be transferred to another empty plate for the staining. The remaining half must be sealed and stored at 2 - 8°C in the dark and used within a month.
- Are these plates made under sterile conditions?
-
The plates are not sterile. You would handle them as you would handle most typical flow cytometry staining protocols.
- How do I request a custom LEGENDScreen™ product with only my specificities of interest?
-
For more info, visit: biolegend.com/custom_solutions.
- What is the level of variability from one experiment to the other?
-
If the protocol is followed closely, the variability should be minimal. The variability should be similar to single vial antibody staining.
- Is there any data analysis tool or algorithm applicable to this product?
-
Currently, we do not offer any automated analysis solutions for LEGENDScreen™ kits. However, a commercial solution is available from Astrolabe Diagnostics. The Antibody Staining Data Set is an example application of the LEGENDScreen™ Human PE Kit (see Amir et al.).
FAQs
- Mini ELISA Plate Reader™をコンピュータに接続できなかったり、ソフトウェアにアクセスできないのですが、どうすればよいですか。
-
Mini ELISA Plate Reader™をmicro-USBケーブルでコンピュータと接続し、装置の電源が入っていることを確認してください。外付けUSBハブは使用せず、装置をコンピュータに直接接続してください。USB接続用のドライバがインストールされていることを確認してください。
- Mini ELISA Plate Reader™には特別な電源が必要ですか?
-
いいえ。製品に付属のmicro-USBケーブルで装置とコンピュータを接続すると、自動的に装置の電源が入ります。
- Mini ELISA Plate Reader™の装置に電源ボタンはありますか?
-
いいえ。付属のmicro-USBケーブルでコンピュータに接続すると、自動的に装置の電源が入ります。
- Mini ELISA Plate Reader™の信号灯が点灯しないのはなぜですか?
-
装置の電源が入っていない可能性があります。Micro-USBケーブルでコンピュータに接続することで、電源が入ります。
- Mini ELISA Plate Reader™のすべての信号灯が同時に点滅しているのはなぜですか?
-
ソフトウェアまたは接続後のセルフテストに関連するエラーの可能性があります。エラーコードと推奨の解決策については、製品マニュアルのトラブルシューティングの項目をご覧ください。
- Mini ELISA Plate Reader™のキャリブレーションに失敗した場合、どうすればよいですか?
-
スロットが空であること、キャリブレーション中にスロット内にマイクロプレートが残っていないことを確認してください。また、スロット内部が汚れていないことを確認してください。Mini ELISA Plate Reader™のクリーニング方法については、製品マニュアルのメンテナンスとクリーニングに関するページをご覧ください。
- Mini ELISA Plate Reader™に使用できるマイクロプレートの種類を教えてください。
-
ELISAに対応している96ウェルのマイクロプレートであればMini ELISA Plate Reader™で使用できます。
- Mini ELISA Plate Reader™用アプリのショートカットを作成する方法を教えてください。
-
インストールの際にプログラムファイルパスに従ってください。アプリのショートカットは、appフォルダにあります。デスクトップにショートカットのコピーを保存することができます。
- Mini ELISA Plate Reader™を用いて定量分析を行う場合、測定後にカーブフィッティング方法を変更することは可能ですか?
-
はい、可能です。保存したデータのファイルを開き、set upから新しいカーブフィッティング方法を適用してください。ソフトウェアが自動的に結果を更新します。
- 定量分析にはどのようなカーブフィッティング方法があるのでしょうか?
-
BioLegendのELISAキット製品の場合、4PL(4パラメーターロジスティック回帰)を使用することを推奨します。他社のELISAキット製品の場合、製品のマニュアルをご確認ください。
- Mini ELISA Plate Reader™で解析する場合、サンプルの希釈倍率はどのように入力すればよいですか?
-
現時点では、アッセイテンプレートの設定中に希釈倍率を入力することができません。データの取得後、手動でサンプルの希釈倍率を適用させることができます。
- In what format can the data files be saved?
-
The files can be saved as PDF or CSV. CSV files can be opened by spreadsheet programs, such as Microsoft Excel.
- What types of assays can I run on the Mini ELISA Plate Reader™?
-
We have used the device to perform endpoint ELISA assays with the sample reading at 450 nm and a reference reading at 620 nm. The device contains 4 LEDs: 405 nm, 450 nm, 492 nm, and 620 nm. Any plate-based assay that requires an absorbance reading at one of these wavelengths should be compatible with the plate reader. Additionally, the device provides the option to measure either endpoint and kinetic assays.
- Is there recommended maintenance for this device?
-
The Mini ELISA Plate Reader™ is maintenance-free. There are no parts within the instrument that can be serviced by the user. Each time the instrument is switched on, an internal self-test is carried out to ensure there are no malfunctions.
FAQs
- What is a GMP recombinant protein or antibody?
-
GMP stands for Good Manufacturing Practice. GMP recombinant proteins and antibodies are manufactured under specific guidelines to ensure product quality and consistency. BioLegend GMP recombinant proteins and antibodies are produced with extensive quality documentation and full material traceability under independent QA oversight.
- What is the difference between BioLegend standard RUO and GMP recombinant proteins and antibodies?
-
BioLegend GMP recombinant proteins and antibodies perform at the same high level as our standard RUO products. No difference in performance should be expected between BioLegend standard RUO and GMP versions. The major difference is the completeness of documentation, material traceability, and independent QA oversight. Additional quality testing may be done depending on the product.
- Are BioLegend GMP recombinant proteins or antibodies animal-free?
-
BioLegend GMP recombinant proteins and antibodies are not animal-free. In all cases where possible, BioLegend attempts to minimize the use of animal components in the manufacturing process. For specific details regarding the use of animal components in the manufacturing process of particular products, please inquire with our technical services team here.
- What is the regulatory status and standards for BioLegend GMP recombinant proteins and antibodies?
-
BioLegend GMP recombinant proteins and antibodies are manufactured in compliance with ISO 13485:2016 and MDSAP. BioLegend GMP recombinant proteins and antibodies are manufactured and tested in accordance with USP Chapter 1043, Ancillary Materials for Cell, Gene, and Tissue Engineered Products and Ph. Eur. Chapter 5.2.12.
FAQs
- What are Flexi-Fluors?
-
Flexi-Fluors are rapidly made-to-order conjugated antibodies. The technology, manufacturing processes, and specifications used to create Flexi-Fluors are the same as our regular catalog products. However, the optimal concentration and performance of each Flexi-Fluor must be determined by the customer.
- How quickly will I receive my order?
-
We aim to ship Flexi-Fluors within 2-3 weeks of receipt of your order. However, depending on your location, shipping times may vary.
- How are Flexi-Fluors different from regular catalog products?
-
Flexi-Fluors are made on demand, specifically for you. Flexi-Fluors are manufactured using the same high-quality standards, and specifications as other catalog products. For faster delivery, Flexi-Fluors are not tested by flow cytometry to determine optimal concentrations or evaluate performance. This testing needs to be performed by the customer.
- How do I determine the optimal concentration for using my Flexi-Fluor? How should I titrate my antibody?
-
Flexi-Fluors are provided at a standard 0.2 mg/mL concentration. We recommend that you titrate your antibody to determine the optimal concentration to use for your application. For many flow cytometry applications, conjugated antibodies perform well at concentrations ranging from 0.03 to 1.0 µg per million cells in 100 µL volume. We recommend that you test a range of concentrations starting from 10 µg/mL.
For example, make five 1:1 serial dilutions of your 0.2 mg/mL antibody. Add 5 µL of each dilution (including the undiluted antibody) to 100 µL of cells (at 107 cells/ml) to test six concentrations - 1.0, 0.5, 0.25, 0.125, 0.06, and 0.03 µg per million cells in 100 µL volume. Compare staining patterns or create a titration curve using the MFI or staining index to determine the optimal concentration.
- I can’t find the antibody-dye combination that I need. When will it be available?
-
We continuously update our catalog, introducing scores of new products every month. Please get in touch with our Technical Service team for an update on new products or recommendations for suitable alternatives to complete your panel. Or contact Custom Solutions to inquire about our affordable custom conjugation services.
- I need help to validate the performance of my Flexi-Fluor. Who should I contact?
-
Please get in touch with Technical Service for assistance.
- Can I order more than 50 μg of a Flexi-Fluor?
-
Yes, you can order multiple vials of the same Flexi-Fluor products. We cannot guarantee, however, that these vials will be bottled from the same lot. For bulk single-lot orders, contact our Custom Solutions team.
- What is the expiration date of my Flexi-Fluor?
-
Expiration dates can be found on the vial label or by using our CoA lookup tool.
FAQs
- If an antibody clone has been previously successfully used in IBEX in one fluorescent format, will other antibody formats work as well?
-
It’s likely that other fluorophore conjugates to the same antibody clone will also be compatible with IBEX using the same sample fixation procedure. Ultimately a directly conjugated antibody’s utility in fluorescent imaging and IBEX may be specific to the sample and microscope being used in the experiment. Some antibody clone conjugates may perform better than others due to performance differences in non-specific binding, fluorophore brightness, and other biochemical properties unique to that conjugate.
- Will antibodies my lab is already using for fluorescent or chromogenic IHC work in IBEX?
-
Fundamentally, IBEX as a technique that works much in the same way as single antibody panels or single marker IF/IHC. If you’re already successfully using an antibody clone on a sample of interest, it is likely that clone will have utility in IBEX. It is expected some optimization and testing of different antibody fluorophore conjugates will be required to find a suitable format; however, legacy microscopy techniques like chromogenic IHC on fixed or frozen tissue is an excellent place to start looking for useful antibodies.
- Are other fluorophores compatible with IBEX?
-
Over 18 fluorescent formats have been screened for use in IBEX, however, it is likely that other fluorophores are able to be rapidly bleached in IBEX. If a fluorophore format is already suitable for your imaging platform it can be tested for compatibility in IBEX.
- The same antibody works in one tissue type but not another. What is happening?
-
Differences in tissue properties may impact both the ability of an antibody to bind its target specifically and impact the ability of a specific fluorophore conjugate to overcome the background fluorescent signal in a given tissue. Secondary stains, as well as testing multiple fluorescent conjugates of the same clone, may help to troubleshoot challenging targets or tissues. Using a reference control tissue may also give confidence in the specificity of your staining.
- How can I be sure the staining I’m seeing in my tissue is real?
-
In general, best practices for validating an antibody in traditional chromogenic or fluorescent IHC are applicable to IBEX. Please reference the Nature Methods review on antibody based multiplexed imaging for resources on validating antibodies for IBEX.
FAQs
- サンプルの一部に異常なシグナルが検出されました。この原因は何でしょうか?
-
フローサイトメトリーや顕微鏡解析でよく使用される蛍光色素の中には、ポリエチレングリコール(PEG)基が組み込まれているものがあります。また、多くの人々の血液中には、検出可能なレベルの抗PEG抗体が含まれています。これらの抗PEG抗体は、特定の濃度で蛍光標識抗体と複合体を形成し、全血を用いて洗浄を行わない方法の解析で異常なシグナルを引き起こす可能性があります。2021年初頭より、全血とPEG化した標識抗体を用いる解析において、異常なシグナルを示すドナーの頻度の増加が観察されるようになりました。予備実験データによると、ドナー集団における抗PEG抗体の頻度および抗PEG抗体レベルが、異常なシグナルと相関関係があることが示唆されています。2021年初頭から広く投与されている新型コロナウイルスワクチンの中には、その成分にPEGが含まれているものがあります。もし、全血を用いる解析を行う場合、そのようなドナー由来のサンプルがあるかもしれません。抗PEG抗体による問題を解決するためには、単純に洗浄ステップを追加するか、ブロッキングバッファーを使用するといったプロトコルの調整を行うことを推奨します。詳細はテクニカルノートをご覧ください。
- F/P比とは何ですか?
-
F/P比(f:p ratio)は、抗体に結合している蛍光色素の平均分子数を表します。この値は異なるメーカー間、さらに同一メーカーでも異なるロット間で大きく異なる可能性があります。アイソタイプコントロールを使用する場合、そのF/P比が一次抗体のF/P比と類似しているか確認することが重要です。
- フローサイトメトリー実験にはどのようなコントロールを使用する必要がありますか?
-
アイソタイプコントロール:すべてのフローサイトメトリー実験において、アイソタイプコントロールを使用することを推奨します。アイソタイプコントロールは既知のタンパク質を認識しないので、抗体のアイソタイプによるバックグラウンド染色の情報を得ることができます。
Fluorescence‐minus‐one (FMO)コントロール:解析に用いるすべての蛍光色素から1種類の蛍光色素を除いて染色したコントロールです。マルチカラー解析においてFMOコントロールを用いることで、除いた蛍光色素のチャンネルへの、他のすべての蛍光色素からの漏れ込みを確認することができます。これは、陽性と陰性の境界にゲートを設定する際に有用です。
未染色コントロール:未染色コントロールを用いることで、解析する細胞種の相対的な自家蛍光レベルを確認できます。 - 蛍光補正(コンペンセーション)とは何ですか?
-
蛍光補正は、ある蛍光を検出するチャンネルへの他の蛍光からの漏れ込み(蛍光スペクトルのオーバーラップ)を補正する作業です。例えば、FITCの蛍光スペクトルは範囲が広いため、FITCシグナルの一部はPEを検出するチャンネルに漏れ込み、まるでPE陽性であるかのように見えます。最近のデジタル方式のフローサイトメーターでは、単染色コントロールを用いて蛍光補正を自動的に適用させることができます。
- 固定は蛍光色素にどのような影響を及ぼしますか?
-
一般的にパラホルムアルデヒド固定は、特に長時間固定した場合、蛍光強度を低下させる傾向があります。これは特に、ナノクリスタルやPEあるいはAPC由来のタンデム色素に当てはまります。また、過度の固定はタンパク質の構造を変化させ、タンパク質に対する抗体の反応性が失われる可能性があります。
- 特定のタンデム色素の分解に細胞が関与する可能性はありますか?
-
Le Roy C, et al. 2009. Cytometry A. 75:882で報告された研究によると、APC由来のタンデム色素は細胞依存性のメカニズムによって分解されます。
- 蛍光色素はどのようにして抗体に標識していますか?
-
蛍光色素を抗体に標識するために、いくつかの方法があります。どの方法を選択するかは、使用する抗体と蛍光色素の種類によって異なります。一般的な方法の1つとして、抗体の第一級アミン(リジン)を介して蛍光色素を標識する方法があります。その他の方法には、ヒンジ領域のスルフヒドリル基を介してマレイミド反応により蛍光色素を標識する方法があります。
- この抗体はターゲットの細胞外ドメインを認識しますか、それとも細胞内ドメインを認識しますか?
-
当社ではエピトープマッピングを実施していませんが、各製品のデータシートに記載のように、品質管理試験を細胞表面染色あるいは細胞内染色のどちらかを用いて行っています。細胞表面染色で試験している場合、抗体が細胞外のエピトープを認識しているということになります。一方、品質管理試験が細胞内染色で行われている場合、そのタンパク質が細胞内に発現していることを意味しますが、それは認識されるエピトープが細胞内のみであることを必ずしも意味するわけではありません。そのタンパク質が細胞表面で発現したり、細胞表面へ輸送されたりすれば、抗体がタンパク質を検出することができる可能性があります。詳細は、使用予定のクローンについて文献などを参照しご確認ください。
- 自分の装置でどの蛍光色素を使うことができるのか調べるには、どうすればよいですか?
-
使用予定の装置の取扱説明書で仕様を確認してください。また、装置に付属のソフトウェアで仕様を確認できる場合もあります。なお、カスタム仕様になっている装置も多く、その場合は取扱説明書の記載と一致しない場合もあることにご注意ください。また、多くの装置には調整可能なフィルターセットがあり、蛍光色素の様々な組み合わせを適切に検出できるよう、装置を設定することも可能な場合があります。使用予定の装置で、実験に用いる予定の蛍光色素を検出できるのかどうか、常にお客様ご自身でご確認ください。
- 蛍光とは何ですか?
-
蛍光とは、ある物質が光を吸収後、放出された光のことです。ほとんどの場合、放出された光の波長は吸収した光の波長よりも長いため、放出された光のエネルギーは低くなります。フローサイトメトリーでは、蛍光色素を標識した抗体を使用します。抗体がサンプル中の抗原に結合し、そこに単一波長のレーザーを照射することで蛍光波長が放出されるので、このシグナルを検出することで抗原を検出することができます。
- Maxpar® Readyフォーマットの抗体をフローサイトメトリー用染色に使用できますか?
-
EDTAを含む溶液で調製したMaxpar® Readyフォーマットの抗体について、当社ではフローサイトメトリー用染色の試験を実施していません。ほとんどの場合、使用できると思われますが、フローサイトメトリー用染色には同じクローンでEDTAを含まない組成の抗体が適しています。状況によっては、EDTAの存在が染色に悪影響を及ぼす可能性があります。
- Maxpar® Readyフォーマットとpurifiedフォーマットの抗体のバッファー組成に違いはありますか?
-
Maxpar® Readyフォーマットの抗体製品のバッファーは、0.09%アジ化ナトリウムとEDTAを含むPBS (pH7.2)です。通常のpurifiedフォーマットの抗体製品のバッファーにはEDTAが含まれておりません。なお、どちらのフォーマットもキャリアタンパク質は含まれておりません。
- フローサイトメトリー実験ではどのバッファーを使う必要がありますか?
-
お客様が使用しているプロトコルで推奨されているバッファーをお使いください。BioLegendでは、多くのフローサイトメトリー用プロトコルとフローサイトメトリー実験に適切なバッファーを選択するためのガイドをご用意しております。
- タンデム色素とは何ですか?また、なぜそれらを使用するのですか?
-
タンデム色素は2種類の異なる蛍光色素を組み合わせた蛍光色素です。蛍光共鳴エネルギー移動(FRET)の原理に基づき、ドナー分子の励起特性とアクセプター分子の蛍光特性を使用しています。これにより、ストークスシフトの大きい(最大励起波長と最大蛍光波長の差が大きい)、新しい蛍光色素を得ることが可能です。
- フローサイトメーターで、フィルターをあるレーザーラインから別のレーザーラインへ入れ替えることは可能ですか?
-
フィルターを交換する場合、Rainbow Calibration Particlesなどの複数のピーク(6‐8)を有するビーズで設定をテストし、元のフィルターでそれらの広がりを確認し、さらに変更後のフィルターでビーズの広がりを再確認することを推奨します。
- 抗体に病原体が全く含まれていないことを保証していますか?
-
BioLegendでは、GoInVivo™シリーズ製品を除き、製品中の病原体の試験は実施しておりません。しかしながら、ご要望がある場合は、カスタム製品扱いとして外部の独立した試験所で試験を実施することは可能です。
- I observed multiple positive peaks when running Compensation Beads. What could be causing this?
-
Multiple positive peaks can occur from insufficient vortexing or mixing of compensation beads. Be sure to vigorously vortex beads for at least one minute before dispensing drops. Longer vortexing helps to disrupt aggregates that can form during storage. Also, ensure that any stray droplets sticking to the side of the tube are thoroughly mixed in with your sample before incubation. If you have already prepared your single-color controls and do not wish to remake them, try setting your positive gate on the major peak, excluding minor stained populations.



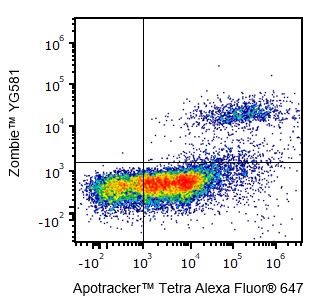



Follow Us